Підсумковий контроль модуля і
«Комплексоутворення та кислотно-основна рівновага в організмі і біологічних рідинах»
1. Указати, як взаємодіють молекули води між собою:
а) диполь-дипольна взаємодія;*
б) іонна взаємодія;
в) іон-дипольна взаємодія;
г) ван-дер-ваальсові сили взаємодії;
д) молекулярна взаємодія.
2. Аномальні властивості води зумовлені:
а) будовою молекул та структурою речовини;
б) закономірною зміною густини зі зміною температури;
в) здатністю розчиняти неорганічні речовини;
г) хімічним складом молекул;
д) здатністю утворювати гідрофобні комплекси з деякими органічними сполуками.
3. Ідеальний розчин – це:
а) розчин, утворення якого із компонентів, узятих в однаковому агрегатному стані та в будь-яких співвідношеннях, не супроводжується тепловим ефектом та зміною об’єму;
б) розчин, у якому концентрація розчиненої речовини дуже мала;
в) розчин, утворення якого із компонентів, узятих в однаковому агрегатному стані та в будь-яких співвідношеннях, суп-роводжується тепловим ефектом та зміною об’єму;
г) розчин, утворення якого із компонентів, підпорядковується певним закономірностям та законам фізики;
д) розчин, у якому концентрація розчиненої речовини коливається у великих межах.
4. Гранично розведений розчин – це:
а) розчин, у якому концентрація розчиненої речовини дуже мала;
б) розчини, утворення яких із компонентів, узятих в однаковому агрегатному стані та в будь-яких співвідношеннях, супроводжується тепловим ефектом;
в) розчин, утворення якого не супроводжується тепловим ефектом та зміною об’єму;
г) розчин з невизначеною концентрацією розчиненої речовини;
д) розчин, який підпорядковується закономірностям неідеальних розчинів.
5. Ідеальні розчини це – розчини:
а) у яких сили взаємодії між різнорідними та однорідними молекулами однакові;
б) у яких сили взаємодії між різнорідними молекулами більші, ніж між однорідними;
в) які підпорядковуються певним фізико-хімічним закономірностям;
г) у яких сили взаємодії між різними молекулами майже не існують;
д) у яких сили взаємодії між однорідними молекулами більші, ніж між різнорідними.
6. Істинний розчин – це:
а) гомогенна, термодинамічно стійка система перемінного складу, яку утворюють кілька компонентів;
б) гетерогенна, термодинамічно стійка система перемінного складу, яку утворюють кілька компонентів;
в) гомогенна, термодинамічно стійка система постійного складу, яку утворюють кілька компонентів;
г) гомогенна, термодинамічно стійка система незмінного складу, яку утворює значна кількість компонентів;
д) гетерогенна, термодинамічно стійка система постійного складу, яку утворюють кілька компонентів.
7. Істинні розчини відрізняються від хімічних сполук:
а) перемінним складом;
б) постійним складом;
в) гетерогенністю;
г) гомогенністю;
д) наявністю деяких хімічних властивостей.
8. До 120 г розчину з масовою часткою солі 8% додали 20 мл води. Масова частка солі в одержаному розчині (у %) дорівнює:
а) 6,85;
б) 7,32;
в) 0,74;
г) 7,18;
д) 0,68.
9. Масова частка солі (у %) в розчині, одержаному після випарювання 40 г води з 200 г розчину з масовою част-кою солі 20%, дорівнює:
а) 25;
б) 15;
в) 35;
г) 17,5;
д) 20.
10. Після випарювання розчину масою 400 г з масовою часткою солі 5%, маса води становила 80 г. Масова частка солі (у %) в розчині після випарювання дорівнює:
а) 6,25;
б) 8,43;
в) 3,18;
г) 4,57;
д) 5,45.
11. Масова частка солі в розчині (у %), одержаному розведенням 500 г 20% розчину солі 750 мл води, дорівнює:
а) 8;
б) 16,8;
в) 0,8;
г) 24,3;
д) 18.
12. Після випарюванню розчину масою 700 г, маса сухого залишку становила 64 г. Масова частка речовини у вихідному розчині (у %) дорівнює:
а) 8,37;
б) 4,22;
в) 9,14;
г) 7,49;
д) 1,26.
13. Мольна частка натрій хлориду в розчині, отриманому розчиненням 58,5 г натрій хлориду у воді об’ємом 162 мл, дорівнює:
а) 0,1;
б) 0,9;
в) 0,8;
г) 0,2;
д) 0,4.
14. Мольна частка піридину в розчині, який містить C5H5N масою 237 г та 126 г води, дорівнює:
а) 0,3;
б) 0,5;
в) 0,2;
г) 0,7;
д) 0,4.
15. Мольна частка хлороформу в розчині, який містить CHCl3 масою 595 г та ацетон (СН3)2СО масою 290 г, до-рівнює:
а) 0,49;
б) 0,69;
в) 4,9;
г) 0,59;
д) 1,5.
16. Мольна частка нітратної кислоти в розчині, який містить 252 г HNO3 та 144 г води, дорівнює:
а) 0,33;
б) 0,45;
в) 0,67;
г) 3,37;
д) 0,53.
17. Мольна частка води в розчині, який містить неорганічну речовину масою 324 г та 108 мл води (молярна маса неорганічної речовини 81 г/моль), дорівнює:
а) 0,6;
б) 0,4;
в) 0,3;
г) 0,7;
д) 0,5.
18. Розчин, об’ємом 200 мл містить сечовину CO(NH2)2 масою 6 г. Молярна концентрація розчину (у моль/л)
дорівнює:
а) 0,5;
б) 1,35;
в) 0,25;
г) 0,75;
д) 1,6.
19 Розчин об’ємом 250 мл містить хром (ІІІ) хлорид масою 37 г. Молярна концентрація цього розчину (у моль/л) дорівнює:
а) 0,93;
б) 0,45;
в) 1,37;
г) 0,5;
д) 2,17.
20. У 750 мл розчину міститься 126 г HNO3. Молярна концентрація розчину (у моль/л) дорівнює:
а) 2,67;
б) 0,64;
в) 0,0028;
г) 0,067;
д) 26,7.
21. Водний розчин об’ємом 400 мл містить етанол С2Н5ОН масою 32 г. Молярна концентрація розчину (у моль/л) дорівнює:
а) 1,75;
б) 0,67;
в) 1,92;
г) 2,55;
д) 1,25.
22. Розчин об’ємом 250 мл містить калій гідроксид масою 7 г. Молярна концентрація розчину (у моль/л) дорівнює:
а) 0,5;
б) 0,4;
в) 0,3;
г) 0,2;
д) 0,6.
23. Розчинність газів у рідинах підвищується:
а) при зниженні температури та підвищенні тиску;
б) при підвищенні температури та підвищенні тиску;
в) при підвищенні температури та зниженні тиску;
г) при підвищенні температури та незмінному тиску;
д) при зниженні температури та зниженні тиску.
24. Указати, як впливає присутність електролітів на розчинність газів у рідинах:
а) знижує розчинність;
б) газ у присутності електроліту взагалі не розчиняється;
в) підвищує розчинність;
г) не впливає;
д) розчинність залежить від ступеня дисоціації електроліту.
25. Колігативні властивості розчинів визначаються:
а) кількістю частинок розчиненої речовини;
б) природою розчиненої речовини;
в) природою розчинника;
г) кількістю розчинника;
д) масою розчиненої речовини.
26. До колігативних властивостей розчинів відносять:
а) підвищення температури кипіння розчинів;
б) електролітичну дисоціацію;
в) тиск насиченої пари;
г) осмолярність;
д) температуру замерзання.
27. Розчини, яким притаманні колігативні властивості:
а) гранично розведені;
б) концентровані;
в) розведені;
г) неідеальні;
д) тверді.
28. Закон, який виражає залежність тиску насиченої пари від концентрації розчину:
а) Рауля;
б) Вант-Гоффа;
в) Генрі;
г) Клапейрона–Менделєєва;
д) Фіка.
29. Указати, як змінюється тиск насиченої пари при збільшенні концентрації розчину:
а) зменшується;
б) зростає;
в) не змінюється;
г) дорівнює зовнішньому (атмосферному) тиску;
д) спочатку не змінюється, а потім зростає.
30. Математичний вираз закону Рауля для гранично розведених розчинів має вигляд:
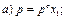
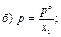 |
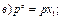
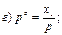
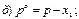
де х1 – мольна частка розчинника.
31. Математичним виразом закону Рауля є рівняння:
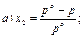
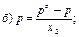
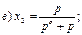
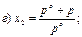
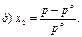
32. Закон Рауля має таке формулювання:
а) для розведених розчинів тиск насиченої пари розчинника над розчином пропорційний його мольній частці в розчині;
б) для розведених розчинів тиск насиченої пари розчинника над розчином більше, ніж тиск насиченої пари над чистим розчинником;
в) для розведених розчинів тиск насиченої пари розчинника над розчином за стандартних умов величина стала;
г) для розведених розчинів тиск насиченої пари розчинника над розчином залежить від концентрації;
д) для розведених розчинів тиск насиченої пари при кипінні змінюється пропорційно температурі.
33. Указати, яке із п’яти тверджень правильне:
а) підвищення температури кипіння або зниження температури замерзання розчину пропорційне моляльній концентра-ції розчиненої речовини;
б) підвищення температури кипіння або зниження температури замерзання розчину дорівнює мольній частці розчине-ної речовини;
в) зниження температури кипіння або підвищення температури замерзання розчину пропорційне моляльній концентра-ції розчиненої речовини;
г) підвищення температури кипіння або зниження температури замерзання розчину пропорційне молярній концентра-ції розчиненої речовини;
д) зниження температури кипіння або підвищення температури замерзання пропорційне масовій частці розчинника в розчині.
34. Умова, при якій наступає кипіння розчину:
а) рівність тиску насиченої пари над рідиною та зовнішнім (атмосферним) тиском;
б) зниження тиску насиченої пари;
в) збільшення тиску насиченої пари над рідиною в порівнянні із зовнішнім (атмосферним) тиском;
г) зменшення тиску насиченої пари над рідиною в порівнянні із зовнішнім (атмосферним) тиском;
д) збільшення концентрації одного з компонентів.
35. Під температурою замерзання розуміють:
а) температуру, при якій тиск насиченої пари над кристалами льоду та над рідиною однаковий;
б) температуру, при якій відбувається замерзання розчину будь-якої концентрації;
в) температуру, при якій відбувається зниження тиску насиченої пари над кристалами льоду;
г) температуру кристалізації ідеального розчину;
д) температуру, при якій тиск насиченої пари над кристалами льоду більший за тиск над рідиною.
36. Під підвищенням температури кипіння розчину (Dtкип) розуміють:
а) різницю між температурою кипіння розчину та розчинника;
б) різницю між температурою кипіння розчинника та розчину;
в) відношення температури кипіння розчину до температури кипіння розчинника;
г) різницю між температурами кипіння розчинів відомої концентрації;
д) абсолютну температуру кипіння розчину.
37. Підвищення концентрації розчину викликає:
а) підвищення температури кипіння та зниження температури кристалізації;
б) підвищення температури кипіння та температури кристалізації;
в) зниження температури кипіння та підвищення температури кристалізації;
г) зниження температури кипіння та температури кристалізації;
д) не впливає на зміну температури кипіння та температури кристалізації.
38. Кріоскопічна та ебуліоскопічна константи залежать від:
а) природи розчинника;
б) концентрації розчину;
в) температури;
г) природи розчиненої речовини;
д) здатності розчиненої речовини до дисоціації.
39. Зниження температури замерзання розчину (Dtзам) – це:
а) різниця між температурою замерзання розчинника та розчину;
б) температура замерзання неідеального розчину;
в) відношення температури замерзання розчину до температури замерзання розчинника;
г) різниця між температурами замерзання розчинів відомої концентрації;
д) різниця між температурою замерзання розчину та розчинника.
40. Ебуліоскопічна константа – це:
а) моляльне підвищення температури кипіння;
б) відносне зниження тиску насиченої пари розчинника над розведеним розчином;
в) моляльне зниження температури замерзання;
г) молярне підвищення температури кипіння;
д) підвищення тиску насиченої пари розчинника над концентрованим розчином.
41. Зниження температури замерзання розчину неелектроліту визначають за формулою:
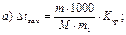
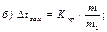
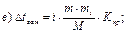
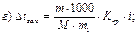
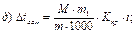
де m1 – маса розчинника, г.
42. Температуру кристалізації 3% розчину калій йодиду визначають за формулою:
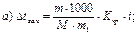
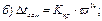
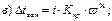
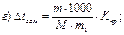
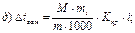
де m1 – маса розчинника, г; і – ізотонічний коефіцієнт.
43. Температуру кипіння 5% розчину глюкози визначають за формулою:
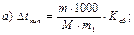
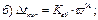
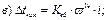
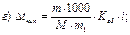
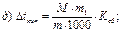
де m1 – маса розчинника, г.
44. Зниження температури замерзання розчинів неелектролітів визначають за формулою:
а) Dtзам = Kкр × Cm;
б) Dtзам = Kкр + Cm;
в) Dtзам = Kкр/Cm;
г) Dtзам = Kкр × N;
д) Dtзам = Cm/Kкр.
45. Підвищення температури кипіння розчинів електролітів визначають за формулою:
а) Dtкип = і × Kеб × Cm;
б) Dtкип = Kеб × Cm;
в) Dtкип = Kеб/Cm;
г) Dtкип = і × Kеб × N;
д) Dtкип = і × Cm/Kеб.
46. Кріоскопічним методом молекулярну масу визначають за рівнянням:
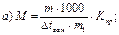
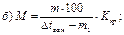
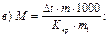
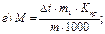
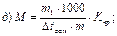
де m1 – маса розчинника, г.
