Расчет термодинамических функций моногидрата лимонной кислоты по результатам измерений теплоемкости
1. Цель работы: рассчитать стандартные термодинамические функции моногидрата лимонной кислоты по результатам измерений теплоемкости методом адиабатической сканирующей калориметрии.
2. Основные определения и формулы
Теплоемкость при постоянном объеме и при постоянном давлении:
 и
и 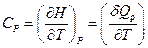 . (1)
. (1)
Уравнения, связывающие между собой изобарную теплоемкость, стандартную энтропию и приращение энтальпии:
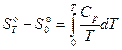 , (2)
, (2)
 , (3)
, (3)
где S0(0) – энтропия вещества при Т = 0 K, равная 0 в соответствии с 3-м законом термодинамики. В лабораторной работе температурную зависимость теплоемкости, энтропии и высокотемпературной составляющей энтальпии рассчитывали с помощью соотношений:
 , (4)
, (4)
 , (5)
, (5)
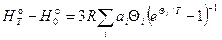 , (6)
, (6)
где ai, Qi (i = 1,2,.. ) – варьируемые параметры, которые наилучшим образом описывают данные адиабатической калориметрии.
3. Первичные экспериментальные данные
В работе были использованы результаты измерений теплоемкости моногидрата лимонной кислоты в интервале температур 21,83–302,79 К.
Табл.1. Результаты измерения низкотемпературной адиабатической теплоемкости
(теплоемкость приведена в Дж•моль-1•К-1)
| T, K | Cp, Дж/(моль*K) | T, K | Cp, Дж/(моль*K) | T, K | Cp, Дж/(моль*K) |
| 0,00 | 0,00 | 54,68 | 62,68 | 193,9 | 184,75 |
| 2,00 | 0,01 | 57,11 | 66,03 | 196,12 | 186,77 |
| 4,00 | 0,09 | 59,86 | 69,64 | 198,48 | 190,13 |
| 6,00 | 0,31 | 63,25 | 73,91 | 200,24 | 190,19 |
| 8,00 | 0,74 | 65,98 | 77,46 | 204,8 | 194,99 |
| 10,00 | 1,44 | 67,06 | 78,76 | 205,84 | 195,03 |
| 12,00 | 2,49 | 67,07 | 78,78 | 213,59 | 202,59 |
| 14,00 | 3,95 | 69,56 | 81,85 | 214,6 | 201,75 |
| 16,00 | 5,90 | 73,87 | 86,81 | 223,45 | 209,32 |
| 18,00 | 8,41 | 75,57 | 88,66 | 226,5 | 210,98 |
| 20,00 | 11,53 | 75,67 | 88,76 | 233,11 | 216,44 |
| 21,83 | 15,40 | 76,16 | 89,31 | 237,98 | 219,38 |
| 21,88 | 15,47 | 81,41 | 94,23 | 242,52 | 223,80 |
| 24,08 | 19,08 | 84,16 | 98,20 | 248,53 | 229,47 |
| 24,34 | 19,44 | 90,11 | 103,32 | 251,68 | 231,36 |
| 26,41 | 22,59 | 91,93 | 105,87 | 258,68 | 236,82 |
| 26,52 | 22,74 | 100,29 | 111,02 | 260,58 | 238,30 |
| 28,48 | 25,91 | 102,5 | 113,77 | 268,44 | 244,60 |
| 29,13 | 26,56 | 111,75 | 122,09 | 269,12 | 245,23 |
| 30,76 | 28,87 | 115,51 | 124,84 | 275,58 | 250,27 |
| 32,12 | 30,85 | 123,56 | 131,92 | 281,07 | 254,48 |
| 33,34 | 32,59 | 127,53 | 133,71 | 287,81 | 259,94 |
| 34,95 | 135,29 | 141,00 | 295,77 | 266,03 | |
| 36,02 | 36,35 | 138,8 | 142,94 | 302,79 | 271,29 |
| 39,36 | 41,12 | 146,2 | 149,26 | ||
| 40,22 | 42,38 | 149,48 | 150,69 | ||
| 44,77 | 48,84 | 157,19 | 157,06 | ||
| 45,76 | 50,22 | 160,8 | 159,51 | ||
| 49,65 | 55,75 | 168,85 | 165,63 | ||
| 51,15 | 57,87 | 181,33 | 173,70 |
4. Результаты численного интегрирования
Результаты обработки низкотемпературного участка кривой теплоемкости представлены на рис.1. При аппроксимации данных вблизи 0 К исходили из предположения выполнения закона кубов Дебая в виде Cp = aT3. Для расчета параметра a использовали данные для интервала 21,83–24,08 К; a = 0,001441.


Рис.1. Низкотемпературный участок кривой теплоемкости моногидрата лимонной кислоты, рассчитанный по закону кубов Дебая
Численное интегрирование кривых Cp = f(T) и Cp/T = f(T) проводили методом трапеций. Рассчитанные значения стандартной энтропии и приращения энтальпии при 298 К приведены в табл.1.
Табл.2. Стандартные термодинамические функции моногидрата лимонной кислоты при 298 К
| Расчет [наст.работа] | Литературные данные | ||
| So298 Дж×К–1×моль–1 | 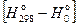 Дж×моль–1 Дж×моль–1 | So298 Дж×К–1×моль–1 | 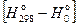 Дж×моль–1 Дж×моль–1 |
| 280,64 | 42416,55 | 283,47 | 43057,07 |
5. Результаты интегрирования аналитических зависимостей Cp(T) = f(T) и Cp/T = f(T)
Параметры температурной зависимости теплоемкости, рассчитанные с помощью программы «fminsi», приведены в табл.3. На рис.2 изображен график температурной зависимости теплоемкости, символы соответствуют экспериментально измеренным значениям.
Табл.3. Параметры уравнения (4)
| a1 | Q1 | a2 | Q2 | a3 | Q3 | a4 | Q4 |
| 2,12 | 89,32 | 10,27 | 1447,19 | 4,03 | 259,28 | 4,92 | 765,77 |
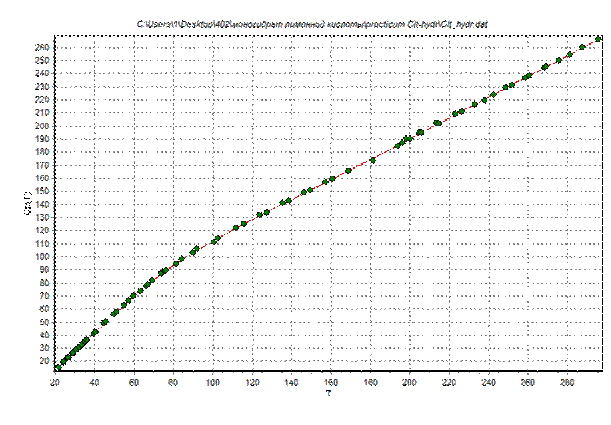 |
Рис.2. Изобарная теплоемкость теплоемкости соединения моногидрата лимонной кислоты Линия – расчет по формуле (4), символы – экспериментальные данные
Значения стандартных термодинамических свойств моногидрата лимонной кислоты, сглаженные с помощью соотношений (4)-(6), приведены в табл.4.
Табл.4. Стандартные термодинамические функции моногидрата лимонной кислоты
| T, K | Cp, Дж×К–1×моль–1 |  , Дж×К–1×моль–1 , Дж×К–1×моль–1 |  , Дж×моль–1 , Дж×моль–1 |
| 56,19 | 36,51 | 1099,28 | |
| 112,10 | 96,87 | 5432,07 | |
| 190,19 | 187,67 | 20573,99 | |
| 267,52 | 269,63 | 43029,43 | |
| 269,02 | 271,23 | 43565,97 | |
| 336,16 | 346,16 | 73970,08 | |
| 385,64 | 410,81 | 110200,13 |
6. Основные результаты работы и выводы:
1) проведено численное интегрирование первичных экспериментальных данных по теплоемкости моногидрата лимонной кислоты;
2) рассчитаны значения SoT и 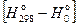 при T = 298 К;
при T = 298 К;
3) показано, что значения стандартной энтропии и приращения энтальпии, рассчитанные численным интегрированием и с помощью соотношения (5) и (6) согласуется между собой и литературными данными.
