Межионное взаимодействие в растворах
Теоретические представления о взаимодействии между ионами разработаны главным образом для сильных электролитов.
Из нескольких предлагавшихся моделей строения растворов сильных электролитов наибольшее распространение получили теория Дебая - Хюккеля и теория ионных ассоциатов.
В 1923 г. П.Дебай и Э.Хюккель предложили рассматривать раствор сильного электролита как систему, в которой растворитель имеет одинаковую во всех точках диэлектрическую постоянную e, а ионы принимаются в первом приближении в виде точечных зарядов, взаимодействующих друг с другом по законам электростатики. Все ионы участвуют в тепловом движении. Поэтому их положение относительно друг друга определяется сочетанием двух эффектов: электростатическим притяжением или отталкиванием по закону Кулона и диффузией.
Для расчета энергии взаимодействия Дебай и Хюккель предложили модель строения растворов электролитов, согласно которой каждый ион находится в окружении ионов противоположного знака, то есть каждый ион считается центральным с ионной атмосферой вокруг него. Объемная плотность заряда в ионной атмосфере r определяется по уравнению Пуассона:
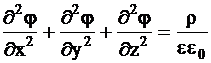 , (3 - 7)
, (3 - 7)
в котором j - электрический потенциал в точке с заданными координатами (точкой начала координат служит центральный ион), e0 - диэлектрическая проницаемость вакуума.
Объемную плотность заряда можно выразить через объемные концентрации ионов в данной точке Сi и их заряды qi:
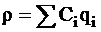
или
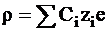 ,
,
где zi - заряд иона в а.е.з. (атомных единицах заряда), е - заряд электрона.
Концентрацию ионов в точке с потенциалом j и с энергией ионов ziej можно найти, используя распределение Больцмана:
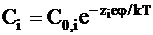 ,
,
где С0,i - объемная концентрация ионов.
Для разбавленных растворов электролитов потенциал j достаточно мал, чтобы считать показатель экспоненты также достаточно малым и воспользоваться приближением типа ex = 1 + x + ... , в результате чего выражение для плотности заряда принимает вид:
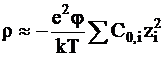 . (3 - 8)
. (3 - 8)
Подстановка (3 - 8) в уравнение (3 - 7) с использованием обозначения
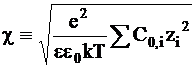
дает
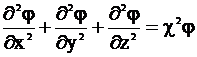 . (3 - 9)
. (3 - 9)
Для решения уравнения (3 - 9) обычно переходят к полярным координатам, вводя в качестве переменной расстояние r от точки с потенциалом j до центрального атома. Его решение таково:
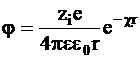 . (3 - 10)
. (3 - 10)
Потенциал j представляет собой среднее значение потенциала, создаваемого на расстоянии r от иона.
При условии r ® 0 потенциал j стремится к потенциалу, создаваемому самим ионом:
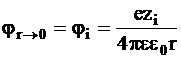 .
.
Разность между этими величинами равна той части потенциала jai, которая относится только к ионной атмосфере:
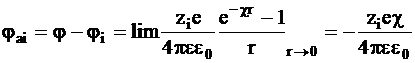 . (3 - 11)
. (3 - 11)
Потенциал jai называется потенциалом ионной атмосферы.
Величина 1/c называется радиусом ионной атмосферы. На этом расстоянии ионную атмосферу можно рассматривать как сферу с зарядом, равным по абсолютной величине, но противоположным по знаку центральному иону. В связи с этим энергия кулоновского взаимодействия центрального атома с ионной атмосферой должна быть равна:
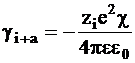 .
.
Так как на один ион приходится половина этой величины, то энергия взаимодействия 1 моль ионов с ионной атмосферой окажется равной
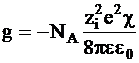 . (3 - 12)
. (3 - 12)
Уравнение (3 - 12) позволяет учесть взаимодействие между ионами в достаточно разбавленных растворах, когда собственными размерами ионов можно пренебречь. В дальнейшем П.Дебай и Э.Хюккель рассмотрели модель, в которой ионы имеют конечные размеры.
Теория Дебая - Хюккеля получила экспериментальное подтверждение.
Образованием ионной атмосферы объясняются эффект Вина и эффект Дебая - Фалькенхагена, которые будут рассмотрены в дальнейшем.
Теория образования ионных ассоциатов (ионных пар, тройников) была предложена В. К. Семенченко в 1924 г. и независимо от него Н. Бьеррумом в 1926 г.
Эта теория предполагает, что в результате электростатического взаимодействия могут образовываться ионные ассоциаты, разрушаемые при тепловом движении. Образование ассоциатов возможно, если энергия электростатического притяжения между ионами превышает среднюю энергию теплового движения частиц, равную 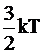 . Это условие можно записать так:
. Это условие можно записать так:
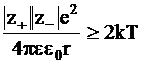 , (3 - 13)
, (3 - 13)
где r - расстояние между ионами, а |z+| и |z-| - абсолютные заряды катионов и анионов, образующих пары.
Рассчитав число ионных пар, находящихся на расстоянии r, равном или меньшем, чем следует из условия (3 - 13), можно найти константу ассоциации - величину, обратную константе диссоциации. Очевидно, что относительное число ионных пар возрастает с уменьшением среднего расстояния между ионами, то есть с увеличением концентрации раствора. В связи с этим в достаточно концентрированных растворах сильных электролитов кажущаяся степень электролитической диссоциации оказывается меньше 1. Образование ионных ассоциатов приводит к уменьшению кинетических единиц электролита в растворе.
Из теории ионной ассоциации следует, что с уменьшением диэлектрической проницаемости среды возрастает константа ионной ассоциации.
Теория электростатической ассоциации находится в качественном согласии с экспериментальными данными по кажущимся константам ионного равновесия в растворах сильных электролитов и их электрической проводимости. Однако в связи с допускаемыми этой теорией упрощениями, позволяющими считать ионы жесткими сферическими частицами, количественные результаты по расчету расстояния между ионами в паре часто не согласуются с данными других методов. Таким образом, теория электростатической ассоциации рассматривается как одно из возможных первых приближений при выяснении взаимодействия между ионами.
