П 15. Электролиз в растворах и расплавах электролитов.
Написание уравнений анодных и катодных реакций, протекающих на электродах при электролизе. Построение поляризационных кривых при электролизе. Расчет количества веществ, полученных на электродах в результате электролиза по законам Фарадея.
Пример 1. Электролиз расплава соли на нерастворимых электродах.
Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока.
При электролизе расплава на нерастворимых электродах
- на катоде ( К–) происходят процессы восстановления катионов.
- на аноде (А+) происходят процессы окисления анионов.
Запишем ионный состав электролита:
LiCl → Li+ + Cl-
и стандартные потенциалы электродных процессов (Приложение 6 [1]):
на К- :  B,
B,
на A+ : 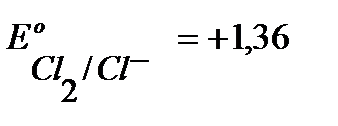 В.
В.
Минимальная разность потенциалов (Umin), требуемая для протекания электролиза, равна разности равновесных потенциалов процессов:
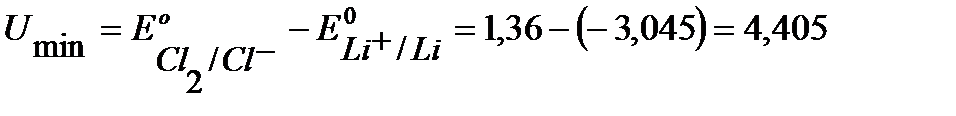 B.
B.
Электродные процессы:
K- : Li+ + 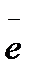 → Li
→ Li
A+ : 2Cl- → Cl2 + 2 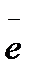 .
.
Данный электролиз можно использовать для получения лития и хлора.
Пример 2. Электролиз водного раствора щелочи на нерастворимых электродах.
Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. При электролизе водных растворов при наличии нескольких видов ионов возможно протекание нескольких электродных реакций.
На катоде ( К–) происходят процессы восстановления: в первую очередь идут процессы, характеризующиеся более положительным потенциалом.
На аноде (А+) могут окисляться анионы, нейтральные молекулы и сам материал анода (нерастворимые аноды – Pt, графит С), в первую идут процессы, характеризующиеся более отрицательным потенциалом.
При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов.
Запишем уравнения диссоциации раствора электролита
КОН → К+ + ОН- ; H2O  H+ + OH-
H+ + OH-
и определим равновесные потенциалы возможных электродных процессов:
К- : 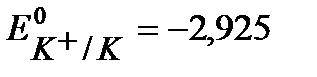 B, (см. Приложение 6 [1]),
B, (см. Приложение 6 [1]),
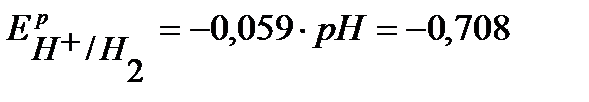 В, (расчет по уравнению Нернста);
В, (расчет по уравнению Нернста);
А+ : 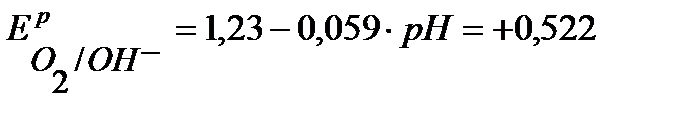 В, (расчет по уравнению Нернста).
В, (расчет по уравнению Нернста).
Так как Е0К+/К значительно отрицательнее  , то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН- :
, то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН- :
К- : 2Н2О + 2е → Н2 + 2ОН- ,
А+ : 4ОН- - 4е → О2 + 2Н2О.
Минимальная разность потенциалов для электролиза данного раствора:
 B.
B.
Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):
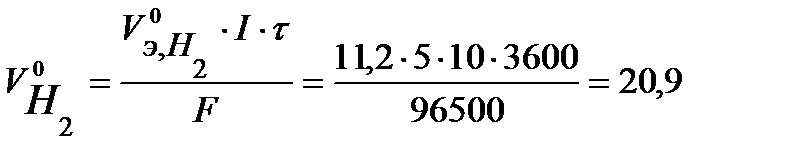 л,
л,
 л.
л.
Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3. Электролиз водного раствора соли на нерастворимых электродах. Расчет выхода по току.
Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2 .
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
CuCl2 → Cu2+ + 2Cl-
H2O  H+ + OH- .
H+ + OH- .
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К- : 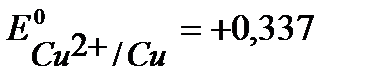 B, (см. Приложение 6 [1]),
B, (см. Приложение 6 [1]),
 B , (расчет по уравнению Нернста),
B , (расчет по уравнению Нернста),
т.к.  более положителен, чем
более положителен, чем  , то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
, то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
A+ :  В, (см. Приложение 6 [1]),
В, (см. Приложение 6 [1]),
 В, (расчет по уравнению Нернста),
В, (расчет по уравнению Нернста),
т.к. 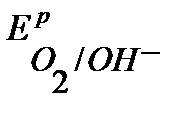 более отрицателен, чем
более отрицателен, чем  , то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
, то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
K- : Cu2+ + 2 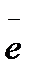 → Cu
→ Cu
A+ : 2H2O → O2 + 4H+ + 4 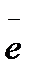
2Cl- → Cl2 + 2 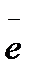 .
.
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (DЕК, DЕА): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (DЕом = R.I). Поэтому напряжение ( U ), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов :
 .
.
Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах:
| О2 , A |
| Cl2,, A |
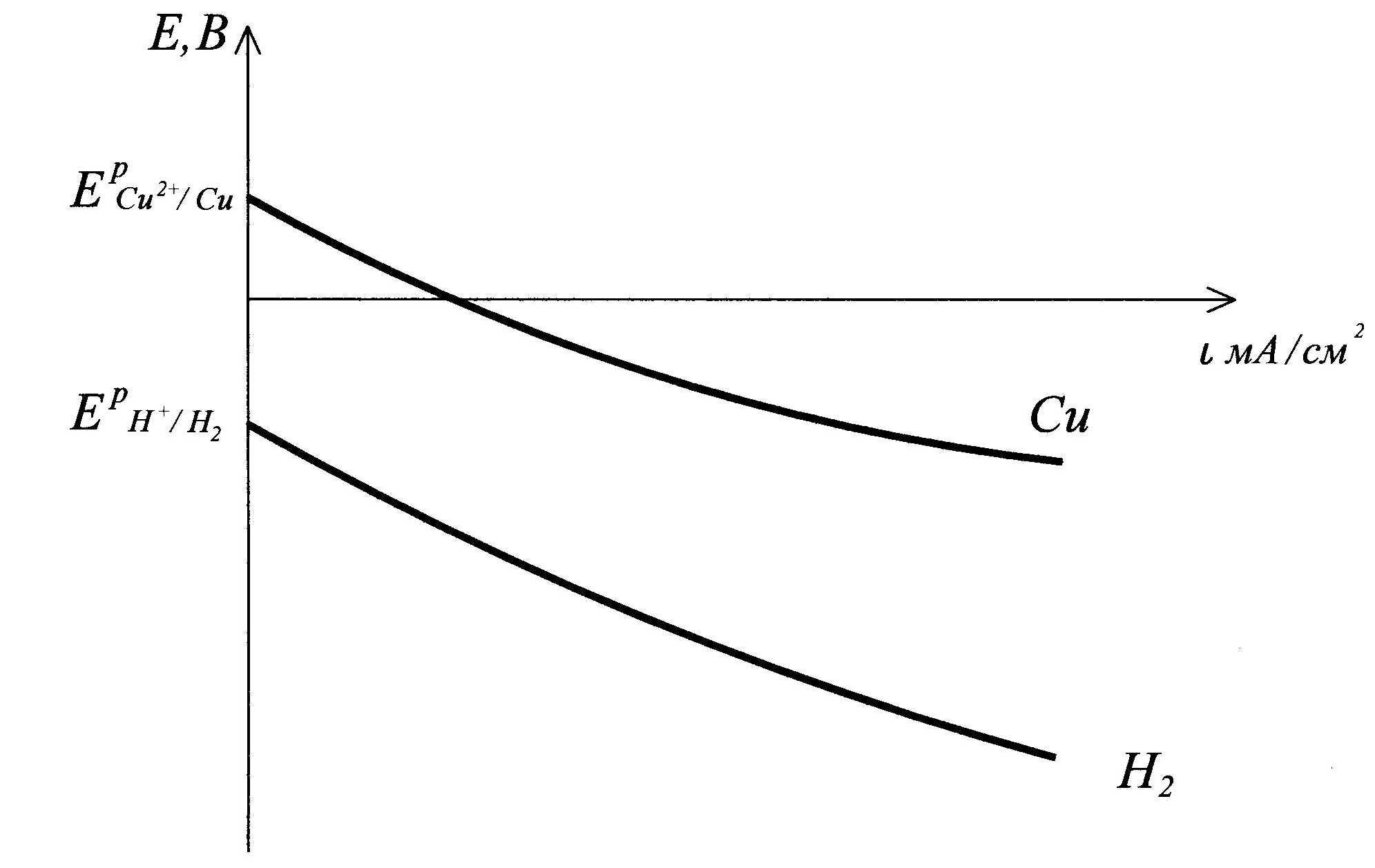


| E, B |
E0  |
Ep 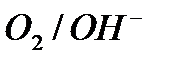 |
Ep  |
| Cu, K |
E0 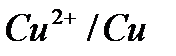 |
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:
 л/моль,
л/моль, 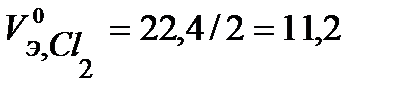 л/моль,
л/моль,
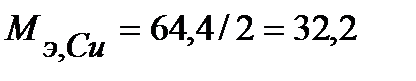 г/моль.
г/моль.
По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):
 Кл,
Кл,
 Кл.
Кл.
Суммарное количество электричества, прошедшее через анод, равно:
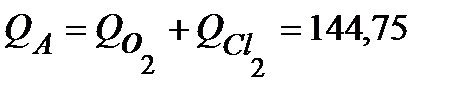 Кл.
Кл.
Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:
 г = 48,3 мг
г = 48,3 мг
Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj ):
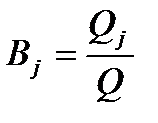 ,
,
где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Определим выход по току (Bj) для всех процессов электролиза:
 %, ( т.к. на катоде идет один процесс );
%, ( т.к. на катоде идет один процесс );
 % ;
% ;  %.
%.
Пример 4. Электролиз водного раствора соли на растворимых электродах.
Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3?
Решение.Если потенциал металлического анода имеет более отрицательное значение, чем потенциал ионов и других веществ, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом.
Ионный состав раствора электролита таков же, как в примере 3, поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:
 В, (см. Пример 3),
В, (см. Пример 3),
 В,
В,
потенциал материала анода 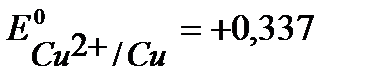 В, (см. Приложение 6 [1]).
В, (см. Приложение 6 [1]).
Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем  и
и  (небольшие поляризации DЕК, DЕА и плотности тока i), то электродные процессы будут следующие:
(небольшие поляризации DЕК, DЕА и плотности тока i), то электродные процессы будут следующие:
K- : Cu2+ + 2 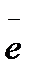 → Cu
→ Cu
A+ : Cu → Cu2+ + 2 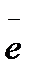 .
.
При больших напряжениях электролизера U , могут быть достигнуты 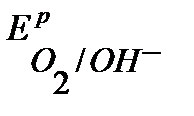 ,
, 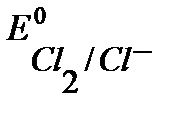 и
и  , тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.
, тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.
Благодаря растворению под действием тока медного анода запас ионов Cu2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр.3.).
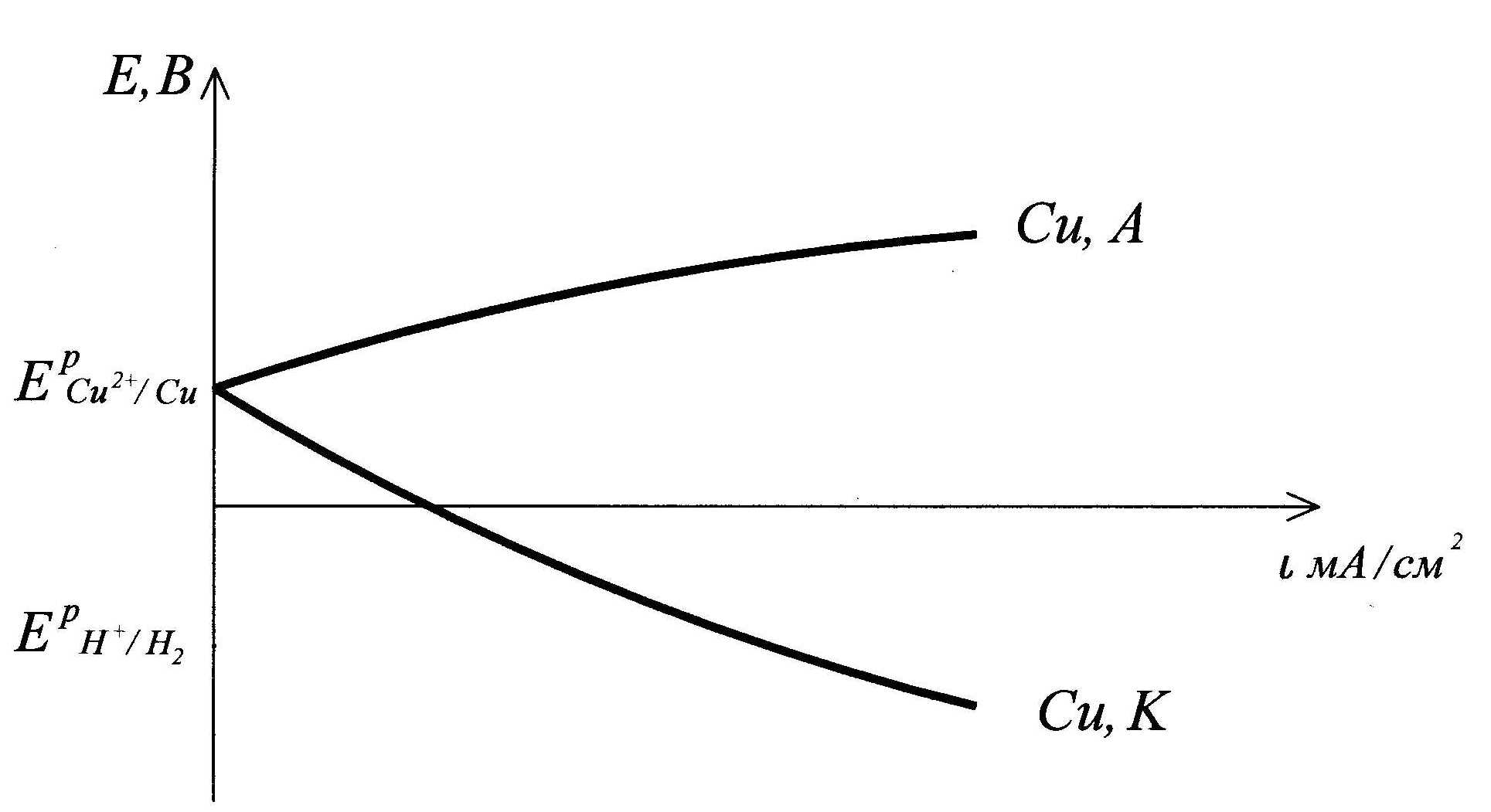
Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах:


Пример 5. Электролиз водного раствора смеси солей. Расчет выхода по току.
Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
Pb(NO3)2 → Pb2+ + 2NO3-
Sn(NO3)2 → Sn2+ + 2NO3-
H2O  H+ + OH- .
H+ + OH- .
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К- : 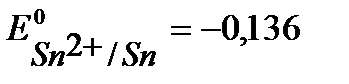 B,
B, 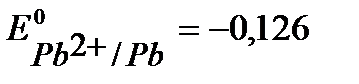 B, (см. Приложение 6 [1]).
B, (см. Приложение 6 [1]).
 В, (расчет по уравнению Нернста).
В, (расчет по уравнению Нернста).
т.к. 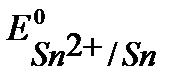 ,
, 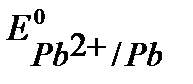 и
и 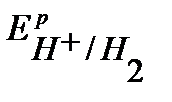 имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита.
имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита.
На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН- .
Таким образом, на электродах протекают следующие процессы:
K- : Pb2+ + 2e → Pb
Sn2+ + 2e → Sn
2H+ + 2e → H2
A+ : 2H2O → O2 + 4H+ + 4 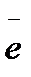 .
.
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:
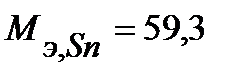 г/моль,
г/моль, 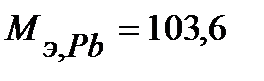 г/моль,
г/моль,  л/моль (н.у.).
л/моль (н.у.).
По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):
 Кл ,
Кл ,
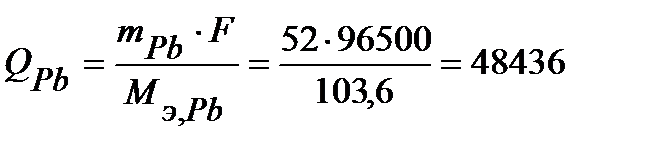 Кл,
Кл,
 Кл .
Кл .
Суммарное количество электричества, прошедшее через катод:
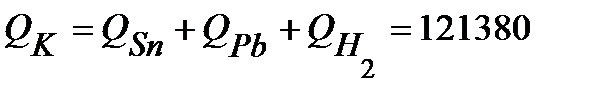 Кл .
Кл .
Определим выход по току (Bj) для всех процессов электролиза:
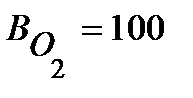 o/o , ( т.к. на аноде идет один процесс );
o/o , ( т.к. на аноде идет один процесс );
 100 % =
100 % =  100% = 40,2%;
100% = 40,2%;
 100% = 39,9%;
100% = 39,9%; 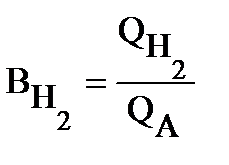 100% = 19,9%.
100% = 19,9%.
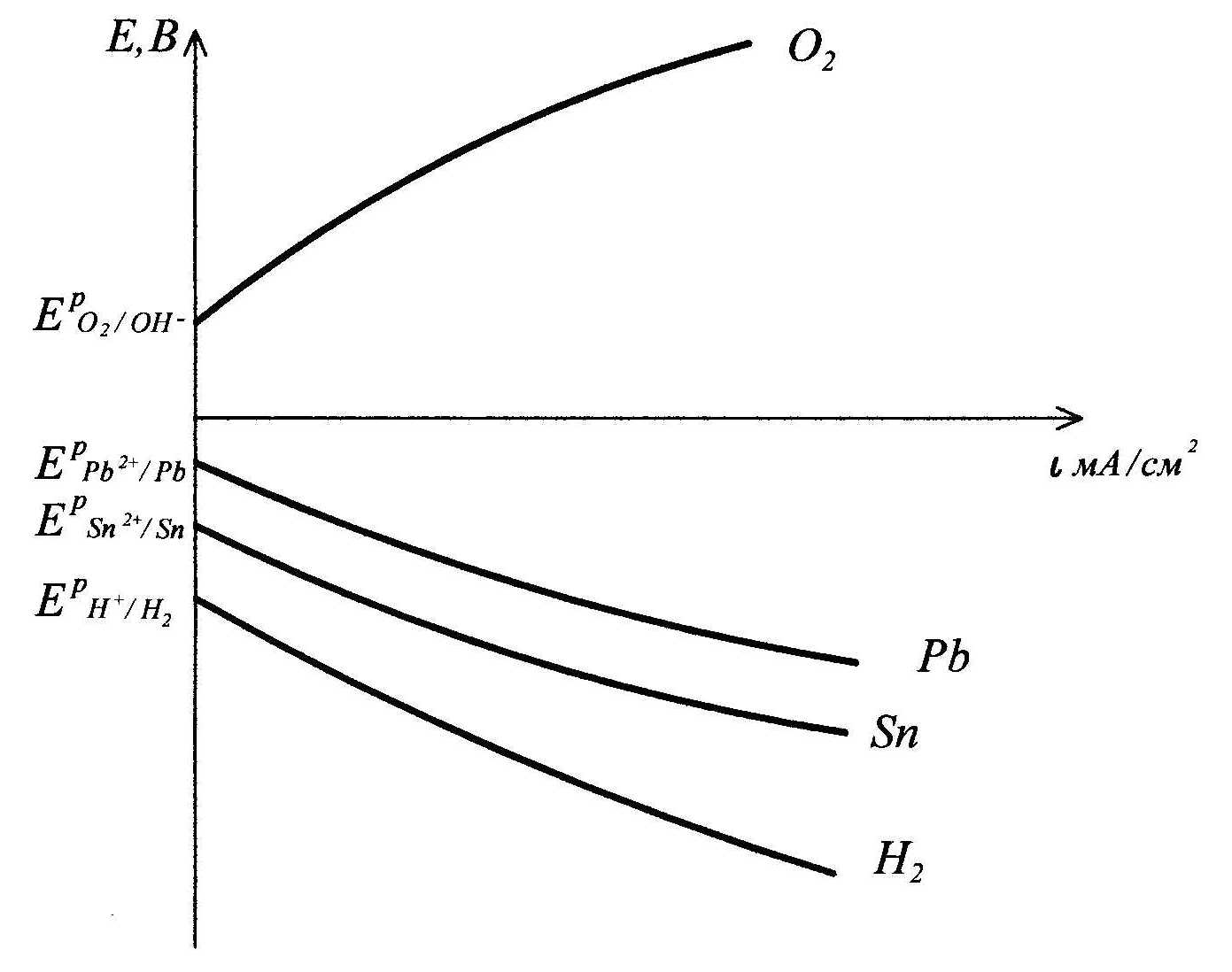
Поляризационные кривые процесса электролиза водного раствора смеси
солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах:
Пример 6. Рафинирование металлической смеси.
Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H+, SO42- , OH-. Запишем равновесные потенциалы возможных электродных процессов при рН = 2:
 B,
B,  B,
B, 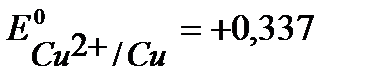 B, (см. приложение 14 [3], приложение Х [2]);
B, (см. приложение 14 [3], приложение Х [2]);
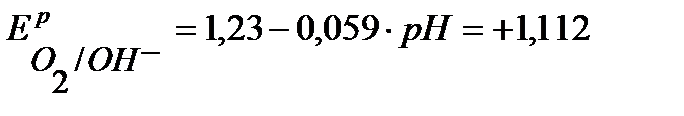 В,
В,  B, (расчет по уравнению Нернста).
B, (расчет по уравнению Нернста).
Так как 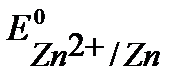 <
<  <
< 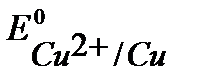 <
<  , то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
, то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
Так как 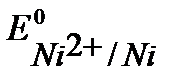 >
> 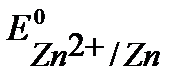 , и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
, и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
Запишем уравнения электродных процессов:
А+ : Zn → Zn2+ + 2e
Ni → Ni2+ + 2e
K- : 2H+ + 2e → H2
Ni2+ + 2e → Ni .
Время, необходимое для рафинирования, рассчитаем по закону Фарадея
(  г/моль) :
г/моль) :
 c или τ = 9,27 ч .
c или τ = 9,27 ч .
