Уравнение состояния идеальных газов
Идеальным называют газ, молекулы которого представляют собой материальные точки: обладают массой, но не имеют объема и никак не взаимодействуют между собой.
Уравнение состояния идеальных газов имеет вид
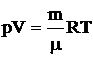 ,(2.1)
,(2.1)
где p – давление газа, Па;
V – объем газа, м3;
m – масса газа, кг;
μ – молярная масса газа, кг/моль;
R – универсальная газовая постоянная, R = 8,31 Дж/моль·К;
T – температура, К.
Уравнение Менделеева-Клапейрона хорошо описывает поведение одного моля любого газа при малых давлениях и высоких температурах. Этому замечательному уравнению подчиняются и воздух, которым мы дышим, и раскаленные газы в топках, и плазма внутри звезды.
Уравнение состояния реальных газов
В действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. Истинный свободный объем, в котором могут двигаться молекулы, будет меньше объема газа V, а давление, под которым находится газ, несколько больше внешнего давления, т. к. из-за межмолекулярного притяжения газ испытывает как бы дополнительное сжатие
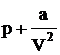 ,
,
где коэффициент а зависит от природы газа.
Поправка к давлению должна быть тем больше, чем ближе друг к другу находятся молекулы в газе, чем более он сжат, чем меньший объем занимает. Эта поправка (а/V2) обратно пропорциональна квадрату объема: чем он меньше, тем ближе друг к другу и тем больше притяжение, а кроме того самих молекул в единице объема больше.
Уравнение состояния реальных газов вывел Ван-дер-Ваальс:
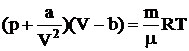 . (2.2)
. (2.2)
Величина b учитывает объем, занимаемый молекулами. Уравнение более точно и применимо в значительно более широких пределах при изменении давления и температуры. Для расчетов, связанных с определением параметров микроклимата, достаточным является использование уравнения Менделеева-Клапейрона.
Газовые законы
Газовые законы являются частными случаями уравнения состояния идеального газа. Если газ из состояния с параметрами p1, V1, T1 в состояние с параметрами p2, V2, T2 и один их параметров при этом остается постоянным, то справедливы следующие законы.
Закон Бойля-Мариотта. Давление некоторой массы газа при постоянной температуре (изотермический процесс) обратно пропорционально объему газа
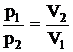 , или
, или
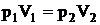 . (2.3)
. (2.3)
Другим и более существенным выражением закона Бойля-Мариотта является формула
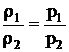 , (2.4)
, (2.4)
где ρ – плотность газа, кг/м3.
Формулы могут быть применены также в том случае, если процесс изменения объема газа не был изотермическим, но изменения температуры были таковы, что и начале и в конце процесса температура данной массы газа была одна и та же.
Закон Шарля. Давление некоторой массы газа при нагревании на 1 0С при неизменном объеме (изохорический процесс) увеличивается на 1/273 часть давления, которое эта масса газа имела при 0 0С:
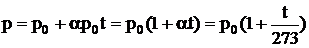 . (2.5)
. (2.5)
Величину α называют температурным коэффициентом давления. Она имеет одно и тоже значение для всех газов α = (1/273) 0С-1.
Закон Гей-Люссака. Объем некоторой массы газа при нагревании на 1 0С при постоянном давлении (изобарический процесс) увеличивается на 1/273 часть объема, который эта масса газа имела при 0 0С:
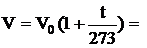
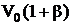 , (2.6)
, (2.6)
где β – температурный коэффициент расширения. Коэффициент β численно совпадает с коэффициентом α.
Законы Шарля и Гей-Люссака можно выразить через термодинамическую температуру:
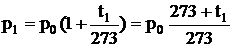 ,
,
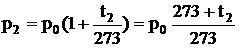 ,
,
Делим одно на другое
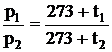 ,
,
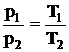 . (2.7)
. (2.7)
Аналогично
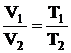 . (2.8)
. (2.8)
При больших давлениях и низких температурах законы неприменимы.
Закон Дальтона.Давление, которое будет иметь любой из газов, составляющих смесь, если удалить остальные газы из объема, занимаемого смесью, называется парциальным (pars – частичный). Дальтон нашел, что давление смеси невзаимодействующих газов равно сумме их парциальных давлений:
р = р1 + р2 + …+ рn. (2.9)
К сильно сжатым газам закон не применим.
Температура
Температура есть количественная мера энергии хаотического молекулярного движения в телах.
Ощущения тепла и прохлады, жары и холода присущи человеку и играют большую роль в его жизни. Однако возможности нашего непосредственного восприятия весьма ограничены. Для определения температуры тел в большом диапазоне ее изменения, а также для точного количественного суждения о ней необходимо прибегать не к непосредственному ощущению, а к приборам.
Латинское слово «температура» означало «смесь». Под температурой тела понимали смесь из материи тела и теплорода тела. Затем понятие самого теплорода было отброшено как ошибочное, а слово температура осталось.
Измерять температуру, подобно тому, как измеряют длину, объем, массу, нельзя потому, что температуры не складываются.
Если мы сольем в бочку несколько ведер холодной воды, то бочка будет заполнена водой. Сумма объемов воды в ведрах будет равна объему бочки. Но сколько бы холодной воды ни влили в бочку, горячей воды при этом не получится. Рассуждение это совсем не смешно и не наивно, и факт этот вовсе не очевиден сам собой. Это важный закон природы, к которому мы просто привыкли, потому что знаем его из опыта.
Невозможна такая единица температуры, которой можно непосредственно измерять любую температуру, подобно тому, как метром измеряют любую длину. Объем, длина, масса – примеры экстенсивных (количественных) свойств системы. Если железный стержень разделить на несколько частей, температура каждой из них от этого не изменится. Температура – пример интенсивных (качественных) свойств системы.
Рассмотрим две какие-либо системы, состоящие из большого числа молекул (газы, жидкости или твердые тела). Приведем их в соприкосновение таким образом, чтобы они химически не реагировали друг с другом, чтобы не происходило переноса вещества из одной системы в другую, чтобы одна система не могла расшириться за счет другой, и вообще, чтобы они не могли обмениваться механической энергией макроскопических движений. При этом остается возможным переход энергии микроскопических, хаотических движений молекул, составляющих эти системы. Другими словами, остается возможным обмен внутренней энергией соприкасающихся систем. Такой обмен может происходить либо при непосредственном соприкосновении, либо через стенку, отделяющую системы одну от другой.
Суммарную энергию, отданную таким путем одним телом другому, будем называть количеством переданной теплоты.
Соприкосновение тел, при котором возможна лишь передача тепла от одного тела к другому называется тепловым контактом этих тел.
При передаче тепла от одного тела к другому будет изменяться энергия хаотического теплового движения молекул в обоих телах, что приведет к изменению ряда физических характеристик этих систем, связанных с тепловым движением. Так для идеального газа, заключенного в сосуде постоянного объема, с ростом энергии молекулярного движения будет возрастать давление, а также и его температура.
Говорят, что две системы имеют равные температуры, если при тепловом контакте их состояния не меняются.
