Ионизация ее природа. Константа и степень ионизации молекул ксенобиотиков.
Ионы и незаряженные молекулы весьма различны по своим физико-химическим свойствам. Так, например, ионы и незаряженные молекулы вступают в разные химические реакции, по-разному проникают через мембраны и по-разному адсорбируются на различных поверхностях.
Поэтому, прежде чем перейти к рассмотрению поступления ксенобиотиков в клетку, процессов их биотрансформации и т. д., необходимо иметь представление о процессах ионизации веществ. Последние в значительной степени определяют биологическую активность чужеродных соединений.
Многие вещества при растворении в воде не повышают ее электропроводности. Это так называемые неэлектролиты (примерами могут служить сахароза, хлороформ), они понижают температуру замерзания воды пропорционально их молярной концентрации.
С другой стороны, кислоты, основания и соли повышают электропроводность воды. Большинство биологически активных веществ представляют собой кислоты, основания и соли, а следовательно, являются электролитами. Все электролиты понижают температуру замерзания воды в значительно большей степени, чем можно было бы ожидать, исходя из их молярной концентрации. Например, в разбавленных растворах соляной кислоты, гидроксида натрия и хлорида натрия данное понижение оказалось в два раза больше ожидаемого. Это послужило основанием для создания Аррениусом теории ионизации электролитов. В водном растворе хлористый водород (соляная кислота) полностью ионизирован на катионы водорода и анионы хлора (Н+ и Сl-), гидроокись натрия – на катионы натрия и анионы гидроксила (Na+ и ОН-), хлорид натрия – на катионы натрия и анионы хлора (Na+ и Cl-). В растворе сульфата натрия понижение температуры замерзания воды оказалось в три раза больше ожидаемого, и это объясняется тем, что вместо одной молекулы Na2SO4 в растворе присутствуют три иона, а именно – два катиона натрия и один анион сульфата.
Как правило, соли в разбавленных растворах полностью ионизированы. Исключения не многочисленны: наиболее известные из них – галогениды ртути, кадмия, свинца. Вследствие полной ионизации солей их биологические свойства целиком определяются свойствами составляющих их ионов. Так, физиологическое действие хлорида кальция определяется действием, свойственным ионам кальция и ионам хлора. Вообще физиологическое действие полностью ионизирующейся соли не может быть меньше или больше суммы действия ее ионов.
Однако эта простая концепция оказывается неверной в тех случаях, когда соль образована слабой кислотой или слабым основанием, так как в результате гидролиза происходит высвобождение некоторого количества незаряженных частиц, биологическое действие которых суммируется с эффектами, вызванными ионами. Аналогично не все кислоты и основания в растворе находятся в полностью ионизированном состоянии. Сильные кислоты (например, соляная) и сильные основания (например, гидроксид натрия) полностью ионизированы при значениях рН от 0 до 14, в то время как слабые кислоты и основания в этих пределах рН имеют разную степень ионизации. Даже небольшие отклонения рН в любую сторону от нейтрального значения (рН 7) могут существенно повлиять на степень ионизации многих веществ (алкалоиды, местные анестетики и т. д.).
Реально степень ионизации в растворе определяется только двумя факторами: рН раствора и рКа кислоты (или основания). Последняя из этих величин (она будет охарактеризована чуть позже) является константой для каждой кислоты или основания. Поэтому при определенной величине рН степень ионизации зависит только от природы кислоты (или основания), при этом не важно, были они нейтрализованы или нет.
Существенной частью теории ионизации Аррениуса явилось применение закона действующих масс для описания состояния ионного равновесия. Так, уксусная кислота (Н3СООН) – это слабая кислота, ионизирующаяся в воде с образованием некоторого количества ионов водорода (Н+) и ацетат ионов (СН3СОО-). Соотношение произведения этих ионов [Н+] [ СН3СОО-] к концентрации неионизированных молекул [СН3СООН] всегда является постоянной величиной и определяет константу кислотности Ка или просто константу ионизации данной кислоты:
[Н+] [СН3СОО-]
 Ка= . (2.1)
Ка= . (2.1)
[СН3СООН]
Величина Ка уксусной кислоты определена экспериментально и равна 1,7×10-5 (при 25 °С).
Иногда выражение «константа диссоциации» используют вместо константы ионизации. Последнее название точнее, т. к. многие комплексы, например системы ферментов, «диссоциируют» на составляющие, а мицеллы – на мономеры. Устанавливающееся при этом равновесие можно выразить через константы диссоциации, также выведенные из закона действующих масс, но эти константы не являются константами ионизации.
Состояние ионизации слабых оснований также может быть охарактеризовано константами кислотности. Например, аммиак – слабое основание, которое может присоединить ионы водорода с образованием ионов аммония. В таком случае ион NH4+ можно рассматривать как слабую кислоту, ионизованную в воде на ионы водорода (Н+) и молекулы аммиака (NH3). Тогда константа ионизации может быть записана в таком виде:
[Н+] [NH3]
 Ка= . (2.2)
Ка= . (2.2)
[NH4+]
Значение константы ионизации в этом случае равно 5,5×10-5 (25 °С).
Приведенные уравнения показывают, что кислота отщепляет ионы водорода, а основание можно характеризовать количественно одной величиной – сродством к иону водорода. Это позволяет применить константы кислотности для описания процесса ионизации как для кислот, так и для оснований.
Как мы видели, величины констант ионизации слишком малы, поэтому значительно удобнее при рассчетах использовать их отрицательными логарифмами
рКа= – lgКа (2.3)
Тогда величина рКа уксусной кислоты будет равна 4,76, а аммиака по аналогии 9,26 (при 25 °С).
Очевидно, что рКа дают возможность легко сравнивать силу разных кислот (или оснований). Чем сильнее кислота, тем ниже ее рКа (чем сильнее основание, тем выше ее рКа). Значения рКа некоторых кислот и оснований приведены в табл. 2.2.
В настоящее время значения рКа установлены для многих соединений. Например, величина рКа около 5 (сравните с рКа уксусной кислоты) типична для большинства монокарбоновых кислот как алифатических, так и ароматических. Величина рКа 10 типична для фенолов. Кислоты, рКа которых выше 7, практически не изменяют цвета нейтральной индикаторной бумаги, а выше 10 – не имеют даже кислотного вкуса.
Для оснований характерны следующие закономерности. Величина рКа 11 (как, например, у этиламина) типична для алифатических, а значение рКа 5 – для ароматических, которые слабее алифатических. Величины рКа представляют собой десятичные логарифмы, следовательно, основность этиламина и анилина различается в миллион раз. Многие алкалоиды и другие биологически активные основания имеют значения рКа около 8. Основания, рКа которых ниже 7, практически не изменяют цвета нейтральной индикаторной бумаги.
Введение в молекулу электрондонорных групп (например, СН3) увеличивает ее основность и уменьшает кислотность, а электронакцепторных (например, NH2) – ослабляет основность и усиливает кислотность.
Степень ионизации любого вещества можно рассчитать при известных величинах рН раствора и рКа вещества с помощью выражений:
 Степень ионизации (%) = – для кислот. (2.4)
Степень ионизации (%) = – для кислот. (2.4)
1+10 (рКа–рН)
Степень ионизации (%) = – для оснований. (2.5)
1+10 (рН–рКа)
Эти уравнения показывают, что степень ионизации данной кислоты (основания) зависит от рН. Эта зависимость не является линейной, а выражается сигмовидной кривой (рис. 2.1).
Анализ этой кривой показывает, что небольшое изменение рН в определенной области может вызывать сильные изменения ионизации, особенно если значение рН раствора близко к величине рКа исследуемого вещества.
Значение рН, при котором кислота или основание ионизированы наполовину, эквивалентно их рКа. Если рН на одну единицу ниже, чем рКа, то кислота ионизирована на 9 %, а основание – на 91 %.
Связана ли степень ионизации с биологическими эффектами, вызываемыми ксенобиотиками, т. е. с биологической активностью ксенобиотиков?
|
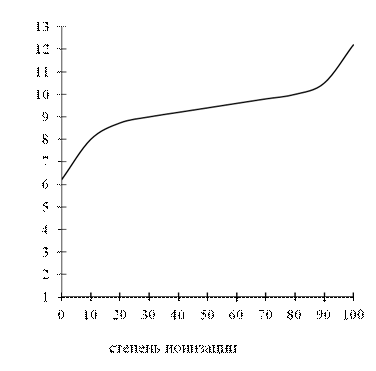
Рис. 2.1. Зависимость степени ионизации молекулы
ксенобиотика от рН
Действительно, оказалось, что в зависимости от степени ионизации ксенобиотики обладают различной биологической активностью и их можно разделить на три большие группы:
1. Ксенобиотики, обладающие большей биологической активностью в ионизированном состоянии.
2. Ксенобиотики, более активные в неионизированном состоянии.
3. Ксенобиотики, проявляющие биологическое действие в виде ионов и неионизированных молекул.
