Описание метода люминолзависимой хемилюминесценции
В качестве объекта исследования можно использовать суспензию лейкоцитов, мононуклеарных клеток или макрофагов перитонеального экссудата экспериментальных животных. Оптимальное количество клеток для регистрации люминолзависимой ХЛ подобрано экспериментально и составляет 1 млн/мл макрофагов и мононуклеарных клеток крови и 2×105/мл лейкоцитов. Для регистрации хемилюминесценции в термостатируемую кювету хемилюминометра ХЛМ-3 помещают: 1 млн клеток; 2,8 мл раствора Хенкса; 2×10-5 М люминола («Serva», Германия). Через 3-5 мин регистрируют спонтанную ХЛ. Затем в кювету добавляют 1,43 мкг/мл опсонизированного сывороткой крови человека зимозана («Sigma», США) и регистрируют индуцированную ХЛ.
Затем оценивают интенсивность ХЛ в милливольтах (или в относительных единицах). Спонтанная ХЛ показывает уровень выработки АФК клетками в организме. Индуцированная различными стимуляторами ХЛ отражает потенциальную, резервную способность клеток отвечать на стимул. Снижение индуцированной ХЛ может служить одним из признаков нарушения бактерицидной функции фагоцитов. Это демонстрируют результаты кинетики ХЛ-ответа нейтрофилов у больных с генитальным герпесом (рис. 3.5).
Так, у больных с генитальным герпесом спонтанная выработка АФК выше, чем у здоровых доноров. Действие опсонизированного зимозана не стимулирует выработку АФК, она остается на уровне спонтанной выработки и значительно ниже показателей таковой у здоровых доноров, что свидетельствует о снижении противовирусного действия нейтрофилов при генитальном герпесе.
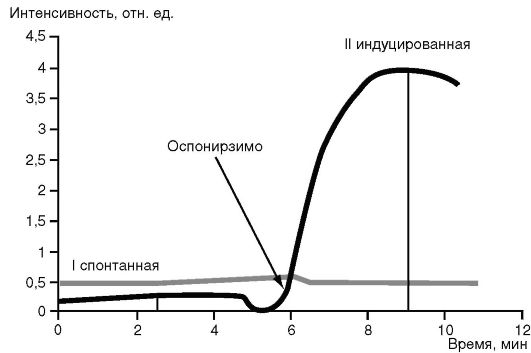 Рис. 3.5.Кинетика ХЛ-ответа нейтрофилов здоровых доноров (черная кривая) и больных с генитальным герпесом (зеленая кривая)
Рис. 3.5.Кинетика ХЛ-ответа нейтрофилов здоровых доноров (черная кривая) и больных с генитальным герпесом (зеленая кривая)
Определение содержания NO в супернатантах культуры фагоцитов in vitro
Оксид азота (NO) участвует во многих физиологических и патологических процессах на уровне как клеток, так и организма в целом, выполняя защитное, регуляторное и повреждающее действия.
Регуляторное действие NO проявляется в поддержании тонуса и проницаемости сосудов, в подавлении адгезии тромбоцитов, в модуляции клеточной адгезии, нейротрансмиссии и бронходилатации, а также некоторых функций почек и иммунной системы.
Повреждающее действие оксида азота реализуется через ингибирование ферментативных функций, индукцию процессов перекисного окисления липидов и повреждения ДНК клетки, повышение чувствительности клетки к воздействию радиации, алкилирующих агентов и токсических металлов, а также через истощение антиокислительных возможностей клетки. Непрямое цитотоксическое действие N0 осуществляется за счет модуляции цитокинового равновесия и опосредованной (через ИЛ-12) активации NK-клеток и цитотоксических лимфоцитов. Сам по себе NO не является мощным
цитотоксическим агентом, но может усиливать чувствительность клеток к действию других цитотоксических агентов. Наиболее выраженной антимикробной активностью обладают соединения, образовавшиеся при взаимодействии АФК и NО в случае их совместной генерации. В результате взаимодействия NO с АФК и с некоторыми другими соединениями образуются цитотоксические агенты, в том числе пероксинитрит (ONOO), S-нитрозотиолы (RSNO), нитрогендиоксид (МЭ2), динитрогентриоксид (N2O3), динитроген-тетраоксид (N2O4) и железодинитрозильные комплексы (DNIC). Однако NО может снижать эффективность окислительного взрыва за счет формирования железонитрильных комплексов, что уменьшает способность железа катализировать прооксидантные реакции.
Эффекты NO принято разделять на основные и опосредованные. Основные включают те реакции, в которых он непосредственно взаимодействует со специфическими биологическими молекулами, например с гуанилатциклазой, цитохромом Р450 и др. Опосредованные эффекты связаны не с самим NO, а с реактивными формами азота, образующимися при взаимодействии NO с кислородом или с супероксидным анионом-радикалом.
Основные эффекты NO имеют место при низких концентрациях NO (менее 1 мкM), тогда как побочные (включая образование радикалов) становятся возможными при более высоких концентрациях NO (более 1мкМ).
Оксид азота in vivo образуется с участием NO-синтазы (NOS), которая у млекопитающих существует в трех изоформах: nNOS - нейтральная (тип 1); iNOS - индуцибельная (тип 2); ecNO-синтаза - эндотелиальная (тип 3).
В макрофагальных клетках функционирует iNOS, экспрессию которой стимулируют некоторые цитокины и микробные продукты, часто действующие в синергизме. NOS типов 1 и 3 называют также cNOS - избирательная, которая присутствует в клетках и может быть активирована притоком кальция с последующим его связыванием с кальмодулином. В присутствии iNOS оксид азота вырабатывается в больших количествах и часто дает побочные эффекты, такие, как перекисное окисление липидов и гидроксилирование, образование нитрозаминов и нитротирозина.
Активированный на цитохроме р450 кислород включается в реакцию образования NW-OH-L-аргинина и является участником одного из наиболее важных этапов в зависимой от NOS-реакции -
окислении гуанидинового азота. Затем гидроксилированная форма L-аргинина при участии супероксидных анион-радикалов и гема превращается в L-цитруллин с одновременным образованием NO.
Для оценки продукции NO перитонеальными макрофагами животных или моноцитами периферической крови человека определяют содержание нитрит-аниона (NO2-) в супернатанте культивируемых клеток (см. Лабораторную работу 3-5) спектрофотометрическим методом с использованием реактива Грисса. Для этого 150 мкл культуральной среды переносят из лунки планшета в пробирку и добавляют последовательно 75 мкл 1,5% раствора сульфаниламида и 1N HCl и 75 мкл 0,15% раствора нафтилэтилендиамминдихлорида в дистиллированной воде (компоненты реактива Грисса). Затем доводят объем раствора до 1 мл. После инкубации в течение 10 мин анализируют оптическую плотность раствора на спектрофотометре (например, на СФ-46) при 540 нм, используя в качестве контроля полную среду культивирования с добавлением раствора Грисса. Продукцию NO выражают в микромолях при помощи калибровочного графика.
Оценка киллинга фагоцитов
Наиболее надежный метод оценки завершенности фагоцитоза - микробиологический, заключающийся в измерении числа бактерий, выживших в лейкоцитах после фагоцитоза.
Принцип метода.Для постановки метода готовят взвесь лейкоцитов и опсонизированных микроорганизмов в соответствующих соотношениях. Через определенные промежутки времени лейкоциты разрушают, делают посевы на питательный агар и через сутки подсчитывают число выросших колоний. Лейкоциты здоровых доноров убивают до 80% бактерий за 20-30 мин (Czuprynski, 1983).
