Фізико-хімічні властивості білків 3 страница
24. Обчисліть молекулярну масу ДНК бактеріофагу Т3, довжина якого 14 мкм.
25. Визначіть коефіцієнт поліконденсації полінуклеотиду з молекулярною масою 1,9 • 10ч дальтон.
26. Визначіть молекулярну масу та довжину дволаншогової ДНК, до складу якої входить 480 000 пар основ.
27. Що таке температура плавлення ДНК? Від чого залежить даний процес?
28. Що таке гіперхромний ефект ДНК?
29. Охарактеризуйте процеси денатурації і ренатурації ДНК.
30. Поясніть основні функції нуклеїнових кислот в організмах людини і тварин.
РОЗДІЛ IV. ФЕРМЕНТИ
Одним з важливих розділів біологічної хімії є вчення про будову, властивості, функції і механізм дії біологічних каталізаторів—ферментів, або ензимів. Вони є органічними сіюлукахщ білкової природи, які утворюються в' жшжх_ор_ганізмах^Х-Зішиі прискорювати пере-іміВН^хгрезтацЮв-^рт^ніїмх- Саме~~їснування життя зумовлене наявністю білків з ферментативними функціями, а обмін речовин у кожній клітині визначається певним набором ферментів. Про роль ферментів у живому організмі І. П. Павлов писав: «... Ці речовини відіграють у житті організмів величезну роль, вони зумовлюють ті хімічні процеси, завдяки яким здійснюється життя»1. Від інших каталізаторів ферменти відрізняються тим, що в природі вони зустрічаються лише в живих організмах, мають високу специфічність і каталітичну дію. Крім того, всі хімічні реакції, які відбуваються за участю ферментів, проходять при нормальному тиску, температурі, близькій до кімнатної, при слабкокислій, нейтральній або слабколужній (у більшості випадків) реакції середовища і т. д. Для ферментів характерним є тс. що синтез їх та каталітична активність контролюються на генетичному рівні, а також за участю цілого ряду низькомолекулярних спо-— субстратів або продуктів реакції.
ХІМІЧНА ПРИРОДА ФЕРМЕНТІВ
Дослідження хімічного складу ферментів свідчать про те, що вони £ білковими речовинами. Для ферментів, як і для білків, характерна висока молекулярна маса. Вона коливається від десятків тисяч до кількох мільйонів (табл. 13).
1 Павлов И. И. Поли. собр. соч.— М. : Изд-во АН СССР, 1962,— Т. 5.—С. 18.
 Таблиця 13. Молекулярна маса ферментів
Таблиця 13. Молекулярна маса ферментів
| Фермент | Молекулярна маса | Фермент | Молекулярна маса |
Рибонуклеаза 13 700 Лактатдегідрогеназа 140 000
Цитохром с 15 000 Альдолаза 142 000
Трипсин 23 800 Каталаза 248 000
Пепсин 32 000 Глутама і дегідрогеназа 336 000
Гексокіназа 45 000 Уреаза 480 000
Лужна фосфатаза 80000 Піруватдегілрогеназа
(комплекс) 4 500 000
Одним із доказів білкової природи ферментів є те, що при розчиненні їх у воді вони утворюють колоїдні розчини і не проходять крізь напівпроникні мембрани. Подібно до білків ферменти є амфотерними електролітами, висолюються нейтральними солями та інактивуються при нагріванні.
Доказом того, що ферменти мають білкову природу, було одержання їх у чистому вигляді і виділення у кристалічному стані. Так, у 1926 р. Дж. Самнер уперше виділив кристали уреази. Пізніше (1930—1931рр.) було виділено у кристалічному стані ферменти — пепсин і трипсин. Тепер одержано більше 400 ферментів у кристалічному стані.
Прямим доказом білкової природи ферментів є лабораторний синтез таких ферментів, як рибонуклеаза (побудована Із 124 залишків амінокислот) і лізоцим (складається із 118 залишків амінокж: Причому обидва синтезовані ферменти за своїми властивостями і каталітичною активністю не відрізнялися від нативиих ферментів.
За хімічною природою ферменти поділяють на дві групи: протеї-. ни (прості ферменти), що складаються тільки з білка, і протеїди (складні ферменти), які містять білок і активну групу небі ікової природи. Білкову частину ферменту часто називають апоферментом, а небілнову — кофактором.
ПРОСТІ ФЕРМЕНТИ
Прості ферменти представлені одним або кількома полі пептиди ими ланцюгами і при гідролізі розщеплюються до амінокислот. Вони належать до таких класів білків, як альбуміни (фермент — естераза печінки), глобуліни (ферменти — уреаза і трипсин) та* до інших груп простих білків. Більшість простих ферментів каталізують процеси гідролізу, наприклад пепсин, трипсин, рибонуклеаза та ін.
СКЛАДНІ ФЕРМЕНТИ
Більшість ферментів належить до групи складних білків. Такі ферменти крім білкової частини містять групу небілкової природи —
кофактор. Численні дослідження свідчать про те, що роль кофакторів v ферментах-протеїдах виконують деякі вітаміни та їх похідні, окремі фосфорні ефіри моносахаридів, нуклеотиди, металовмісні комплекси, атоми заліза, міді тощо. Зараз усі кофактори ферментів поділяють на коферменте, простетпчні групи та .активатори^
Коферменти зв'язані з білковою час ферменту слабкими
електростатичними або вандерваальсівськими силами. З'єднання коферменту з білковою частиною підвищує його стійкість проти різних зовнішніх факторів. Коферменти у ферментах-протеїдах виконують роль переносників різних функціональних груп, атомів, електронів і протонів. Окремі коферменти беруть участь в активуванні молекул субстратів.
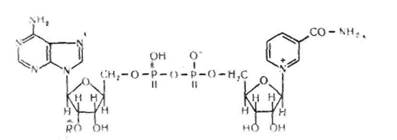
!! і к о т и н а м і д н і коферменти — це найбільш поширена численна група коферментів. До складу пікотинамідпих кофермен-тів входить залишок аміду нікотинової кислоти (вітаміну РР). Основними представниками цієї групи коферментів єнікотинамідаденінди-нуклеотид (НАД+) і нікотинамідаденіндинуклеотидфосфат (НАДФ+):
 |
О С)
де НАД+ має групу R—Н, а НАДФ+ — R—РО (ОН)а. Як бачимо,
НАДІ складається з однієї молекули АМФ і однієї молекули моно-
нуклеотидуЛаСзотнстою основою якого є амід нїкотиновоТ кислоти.
'АМФ і мононуклеотид з'єднані між собою кисневим містком, який
утворюється між їхніми залишками фосфорних кислот. НАДФ від
різняється від іЧАД^им, що містить не два, а три залишки фосфор
ної кислоти, причому третій її залишок зв'язаний з др^пім_атомомвуг
лецю молекули рибози. лтученІГіГТГдепітзмТ
Нікотинамідпі коферменти входять до складу ферментів класу ок-сидоредуктаз. Ці ферменти беруть участь в окисленні та відновленні субстратів (етанолу, молочної кислоти та ін.) і перенесенні протонів та електронів на інші ферменти або субстрати. В організмі НАД знайтися переважно в окисленій формі, а НАДФ — у відновленій.
•Ііпоєва кислота є коферментом окислювально-відновних ферментів, що беруть участі, у процесах окислювального декар-боксилювання кетокислот. Вона легко окислюється і відновлюється.
утворюючи дисульфідні зв'язки або сульфгідрильні групи:
У клітинах організму 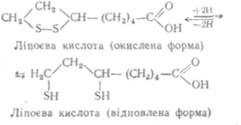 частина ліпоєвої кислоти зв'язана з білком пептидним зв'язком через бічний Ланцюг залишку амінокислоти лізину.
частина ліпоєвої кислоти зв'язана з білком пептидним зв'язком через бічний Ланцюг залишку амінокислоти лізину.
У б і х і н о п и — це група жиророзчинних речовин, які містяться в усіх клітинах організму. Вони мають таку будову:
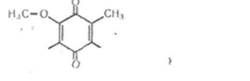 |
н.с-о тсн.,-сн=с-сп,-!„н
СІ І,
Число п у різних убіхіпонів може бути від 4 до 12. Наприклад, якщо п == 4, то такий убіхінон позначають УХ4 і т. д. Убіхінони беруть участь у процесах тканинного дихання. Вони переносять електрони від флавіпових ферментів на цитохромну систему.
Тетрагідрофоліева кислота (ТГФК) є гомологом фолієвої кислоти, в якої відновлені атоми водню і азоту знаходяться в положеннях 5, 6, 7 і 8:
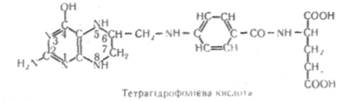
Тетрагідрофоліева кислота входить до складу (|>ерментних систем, які беруть участь у процесах перенесення одповуглєцевих залишків. Коферментних форм тетрагідрофолієвої кислоти є декілька. їх назва походить від назви одновутлецевих залишків, перенесення яких вони каталізують, наприклад, 5-метил-ТГФК, 5-оксиметил-ТГФК,, 10-с}юр-міл-ТГФК і т. д.
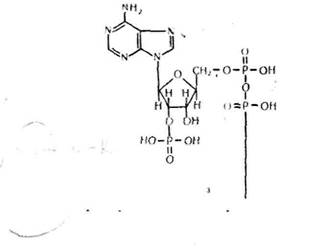
К о ф є р м є н т А (коензим А). Для його позначення використо-ться скорочена форма — КоА — SH. Коензим А складається із
3'-фосфоадснознн-5'-дифосфату і пантотеїну, який утворюється внаслідок з'єднання вітаміну пантотенової кислоти з меркаптоетиламіномі
 |
SH
і
сн2
І
сн„ о но он си
І ' II Г II І і
mh-c-ch,-ch,-n-c-c-c-ch,-0
І І
ч. Н СН3
Коензим ^
Коензим А бере участь у процесах обміну речовин в організмі: в окисленні і синтезі жирних кислот, нейтральних жирів і фосфатидів, біосинтезі стероїдів, у біохімічних перетвореннях циклу трикарбоно-вих кислот і циклу гліокеилової кислоти та в інших процесах. Відомо багато реакцій перенесення, оксиредукції, конденсації, ізомеризації і розщеплення ацильних груп, у яких беруть участь ацилтіоефіри ко-ензиму A (R—CO ~ S—КоА).
Г л у т а т і о н. Цей кофермент є трипсптидом. Він побудований із залишків L-глутамінової кислоти, /.-цистеїну і гліцину. Глутатіон може бути у двох формах — відновленій (TSH)
HOOC-CH-CH2-CH2-CO-NH-CH—CO-NH-CH2—COOH
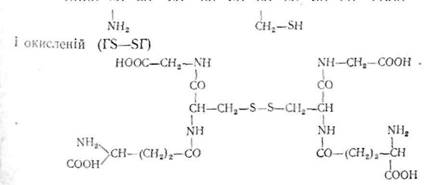
М
Глутатіон бере участь в окислювально-відповних процесах орга-Крім того, відновлена форма глутатіону є коферментом деяких ферментів, що каталізують реакції ізомеризації.
Простетичні групи. З апоферментом простетичні групи зв'язані ковалентними зв'язками. Молекули таких ферментів дисоціюють слабко або не дисоціюють зовсім. Найчастіше в ферментах-протеїдах зустрічаються такі простетичні групи.
Ф л а в і н н у к л є о т и д и. До флавіннуклеотидів належать флавінмононуклеотид (ФА\Н) і флавінаденіндинуклеотид (ФАД):
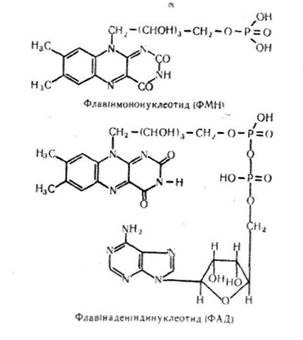
Ферменти, які містять флавінові простетичні групи, -беруть участь в окислювально-відновних реакціях клітинного дихання. Вони переносять електрони і протони від відновлених нікотинамідних кофер-ментів до цитохромів, беруть участь в окисленні альдегідів, амінокислот, глюкози, дегідруванні похідних коферменту А та ін.
Тіамінпірофосфат виконує функції простетичної групи у ферментах, які каталізують просте та окислювальне декарбокси-лювання а-кетокислот, беруть участь у реакціях синтезу і розгцеплеи-
 |
| ця а-окси кетон їв і дикетонів: NH, |
/Цч J ^s^^ch^cHj-o-p-o-p-oh
С он он
Тіамінпірофосфат
Значний вплив на каталітичну активність тіамінпірофосфату мають піримідинове кільце і сірка, яка^входить до складу тіаміну. Вони значно посилюють функцію тіазолового кільця і позитивно впливають на зв'язування простетичної групи з апоферментом.
Піридоксальфосфат і піридоксамінфосфат є похідними вітаміну Вв і мають таку будову:
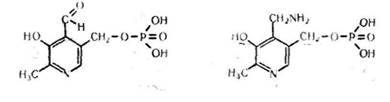
Піридоксальфосфат Піридоксамінфосфат
Ферменти, які містять дані сполуки, відіграють важливу роль в білковому обміні. Вони каталізують реакції переамінування амінокислот, їх декарбоксилювання, розщеплення, синтез і т. д.
Біотин входить до складу ферментів, які каталізують реакції карбоксилювання і перенесення карбоксильних груп:
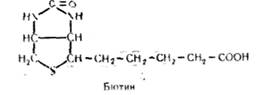
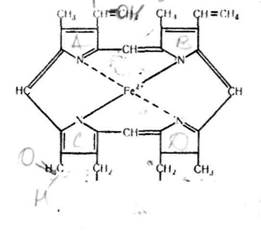
Залізопорфіринові комплекси є простетичною групою ферментів — каталази, пероксидазн і цитохромів. Ці комплек-іають таку саму будову, як і гем гемоглобіну (див. с 176).
Ферменти, які містять залізопорфіринові комплекси, відіграють важливу роль у процесах тканинного дихання як переносники електронів до кисню.
Активатори ферментів. До цієї групи належать такі кофактори, які прискорюють реакції, що каталізуються ферментами. Активаторами часто є іони металів — магнію, цинку, марганцю, кобальту та ін.
 |
■ :Г у1'
соон s соон
Залпопорфіриінжий комплекс
Необхідно підкреслити, що поділ кофакторів на коферменти, про-стетичні групи та активатори до певної міри умовний. Наприклад, в окремих випадках у ферменту оксидази О-амінокислот кофактор — ФАД з білковою частиною зв'язаний не міцно і виступає як кофермент. Цей же кофактор зв'язаний міцно (ковалентно) з ферментами тканинного дихання, виконує в них уже функцію простетичної групи. Між іонами металів, які входять до складу ферменту, та іонами, які активують каталітичний процес, чіткого поділу немає.
Розглядаючи хімічну природу ферменті в-протеїді в, потрібно зауважити, що білкова і небілкова частини окремо ([юрментативної активності не виявляють. Така активність спостерігається тільки тоді, коли білкова частина з'єднана з небілковою. Вважають, що небілкова частина підвищує стійкість білкової частини, а остання зумовлює специфічність каталітичної дії ферменту. Небілкова частина, приєднуючись до різних білків, може каталізувати зовсім інші процеси.
Активний центр ферментів
Вивчення специфічності і каталітичної дії ферментів дало можливість встановити, що субстрат зв'язується не з усією молекулою ферменту, а з окремою її ділянкою, яка називається активним центром. Оскільки активний центр визначає специфічність і каталітичну активність ферменту, то він повинен складатися із структури певного ступеня складності, яка може зближуватися і взаємодіяти з молекулою субстрату.
/ складних ферментах (протеїдах) активний центр утворений кофактором і залишками амінокислот; у простих ферментах (протеїнах) активний центр представлений певною комбінацією залишків амінокислот, які розміщені на відповідній ділянці молекули ферменту. До
складу активного центру більшості простих ферментів пходять залишки амінокислот цистеїну, сери ну, аргініну, аспарагінової і глутамі-нової кислот, гістидину, ги роя і ну і триптофану. Серед них важливе значення мають групи HS (цистеїну), групи ОН (серину), імідазоль-не кільце гістидину. Певну роль відіграють функціональні групи інших залишків амінокислот, зокрема карбоксильні групи аспарагінової і глутамінової кислот та індольна група триптофану. При цьому необхідно зауважити, що такі функціональні груптг-^вашщсні в полі-пептидпих ланцюгах ферменту на рТзпГи відстані одна вІТГ одної. їх зближення з утворенням активного центру відбувається тільки внаслідок формування властивої для ферменту вторинної і третинної структур. Отже, активний центр ферменту складається із функціональних груп, які відповідно зорієнтовані у просторі. Порушення третинної і вторинної структур призводить до зниження або повної втрати активності ферменту. Це можна спостерігати при дії на ферменти високої температури, тобто коли відбувається їх денатурація, яка супроводжується деформацією структури білка.
Деякі ферменти мають_два_і більше активних центри. В активному центрі відрізняють так звану каталітичну ділянку, яка безпосередньо взаємодіє з субстратом, і контактну (якірну) ділянку, яка зумовлює спорідненість до субстрату і формування його комплексу з ферментом.
Такий поділ активного центру ферменту є досить умовним, оскільки взаємодія в контактній ділянці фермент-субстратиих сполук значною мірою впливає на швидкість перетворень, які відбуваються на каталітичній ділянці ферменту. Умовний характер має також і саме відділення активного центру від інших частин ферменту, оскільки вони мають важливе значення в утворенні його нативної структури і впливають на реакційну здатність функціональних груп активного центру. Отже, за каталітичну активність ферменту відповідає вся структура його молекули.
.Крім активного центру в молекулі ферменту може бути також ало стеричний центр (центри) (від грец. алое — другий, інший і стереос — просторовий, структурний). Алостеричний центр — це ділянка молекули ферменту, яка в результаті приєднання до неї низькомолекуляр-сполуки зумовлює зміну просторової (третинної), а іноді і четвертинної структури ферменту. Це. в свою чергу, призводить до зміни конфігурації активного центру, що зумовлює зміну каталітичної активності, тобто підвищує або знижує каталітичну активність. Цей процес є основою так званої алостеричної регуляції ферментативної
ивності. Ферменти, активність яких контролюється етапом актив-
о та адостеричного центрів, називаються алосгперичними ферментами. Характерною особливістю цих ферментів є наявність у молекулі олігомерного ферменту декількох активних і алостеричних центрів. Функціональна активність цих центрів тісно взаємозв'язана між собою і структурою усієї молекули ферменту.
МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Вивчення механізму дії ферментів є однією з найбільш важливих і складних проблем ензимології. За останні десятиріччя досягнуто певних успіхів в її розв'язанні. Зараз запропоновано цілий ряд теорій, які пояснюють механізм дії відповідних ферментів. За основу взято той факт, що ферменти значно знижують енергію активації тих чіт інших реакцій, тобто енергію, яка необхідна для аКіШЯЦІ і "моЛекул реагуючих речовин, щоб відбувалася відповідна реакція. Наприклад, для розщеплення пероксиду водню на кисень і воду без каталізатора необхідна енергія активації 75,2 кДж/моль. При використанні каталізатора (колоїдної платини) енергія активації зменшується до 50,2 кДж/моль, а в присутності ферменту каталази — до 8,3 кДж'моль. Отже, каталізатори значно знижують енергію активації, причому ферменти краще, ніж неорганічні каталізатори, що свідчить про їх високу каталітичну дію.
Більшість дослідників вважають, що механізм дії ферментів у процесах каталізу тих чи інших реакцій пов язаний з утворенням" фер-мент-субстратних комплексів. За цих умов фермент змінює молекулу субстрату так, що енергія, яку необхідно прикласти для переведення її в активний стан, значно зменшується. Можливість утворення фер-мент-субстратних комплексів за допомогою спектроскопії довели Д. Кейлін і Т. Манн з ферментом пероксидазою. У 1962 р. японські вчені К. Ячі і Т. Озава одержали фермент-субстратний комплекс ок-си іази D-амінокислот і аланіну в кристалічному стані. Його можна виділити тільки в анаеробних умовах, оскільки в присутності кисню він відразу розкладається на фермент і продукти реакції. Океидаза D-амінокислот каталізує реакції окислювального дезамінування амінокислот.
При взаємодії ферменту з субстратом між ними можуть утворюватися різні типи зв'язків: іонні, водневі і гідрофобні. Є прямі докази, які свідчать про те, що фермент може зв'язуватися з субстратом (в окремих випадках) і за допомогою ковалентних зв'язків.
Зв'язування ферменту з субстратом здійснюється в основному через активний центр. Використання рентгеноструктурного аналізу та інших' методів електронного парамагнітного і ядерно-магнітного резонансу дало можливість встановити, що активний центр більшості ферментів розміщений на поверхні глобул в їх заглибленнях,впадинах і щілинах (рис. 51)! Це, очевидно, зумовлює більш міцне і надійне зв'язування ферменту з субстратом і підвищує специфічність їх взаємодії. Тут має місце висока відповідність між ферментом і субстратом по типу «замок — ключ». Цю гіпотезу запропонував німецький вчений Е. Фішер, який порівнював фермент і субстрат як ключ з замком (рис. 53;. Він передбачав, що фермент підходить до свого субстрату як ключ до замка. Е. Фішер вважав, що фермент має жорстку струк-
| Щмина |
туру і якщо «ключ» трохи видозмінено, — Субстрат
 то він уже не підійде до свого «замка».
то він уже не підійде до свого «замка».
| Рис. 31. Модель молекули ферменту лізоциму за даними рентгено-структурного аналізу |
Американський учений Д. Кош-ленд висунув гіпотезу, яка змінює запропоновану Е. Фішером уяву гш0 жорсткість відповідної структури ферменту і субстрату на уяву про гнучкість і еластичність активних центрів у молекулі ферменту. Д. Кошленд вважає, що конформація молекули ферменту та його активного центру може змінюватися під дією субстрату і коферменту. На рис. 52 схематично показано молекулу ферменту і функціональні групи — А, В і С. Приєднання субстрату або коферменту до ферменту змінює структуру активного центру, і його функціональні групи розміщуються так, що може відбуватися реакція.
Під час каталітичного процесу утворення фермент-субстратного комплексу відбувається поетапно (рис. 53>. На першому етапі ферментативного каталізу субстрат з'єднується з ферментом, на другому — відбуваються активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів і на останньому (третьому) етапі — відділення продуктів реакції від ферменту. Схематично ці етапи можна
показати так:
Е + S ті ES — F.S* -* Е + Р,
де Е — фермент; S — субстрат; ES — первинний фермент-субстрат-ний комплекс; ES* — активований комплекс; Р — продукт реакції. Необхідно відмітити, що найшвидше реакція відбувається на першому етапі. Низька енергія активації свідчить про те, що в первин-
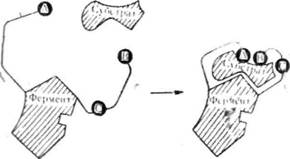 |
Рис. 52. Зміна конформації активного центру ферменту під дією субстрату
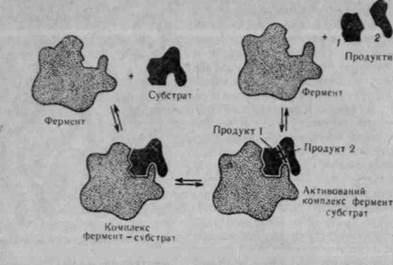
Рис. 53. Схема взаємодії ферменту э субстратом
ному комплексі фермент і субстрат зв'язуються за рахунок слабких типів зв'язку. На другому етапі перетворення молекули субстрату відбувається з розривом і утворенням ковалентних зв'язків. На цьому етапі фермент змінює молекулу субстрату так, що міцність окремих хімічних зв'язків зменшується, в результаті чого знижується енергія активації і реакція відбувається з великою швидкістю.
Отже, фермент знижує бар'єр активації реакції, яку він катал і-зуе, ділячи її на ряд проміжних етапів, кожний з яких не зустрічає енергетичних перешкод. Основна роль у механізмі ферментативного каталізу належить фермент-субстратним комплексам.
ІЗОФЕРМЕНТИ
Відомо, що цілий ряд ферментів має четвертинну структуру, тобто побудовані з двох, чотирьох і більшої кількості субодиниць. При цьому субодиниці бувають двох різних типів. Такі субодиииці, з'єднуючись між собою в різних співвідношеннях, утворюють кілька форм одного і того самого ферменту, тобто ізоферменти. Вони мають однакову субстрату специфічність і однаковий механізм каталітичної дії. Ізоферменти відрізняються між собою окремими фізико-хімічними та імунологічними властивостями, каталітичною активністю. За'раз відомі такі ізоферменти: лактатдегідрогенази (ЛДГ\), креатинази, лужні фосфатази, малатдегідрогенази, фосфоглюкомутази, ізоцитратде-гідрогепази та іп.
Найбільш детально вивчено ізоферменти лактатдегідрогенази. Молекулярна маса ЛДГХ 140 тис. її молекула складається із 4 суб-
1*0
одиниць з молекулярною масою 34—35 тис. кожна. У складі ЛДГ, є два типи субодиниць — Н і М. Таке позначення дано їм у зв'язку з тим, що субодиниця Н переважає в серцевому м'язі (від англ. heart — серце), а субодиниця М — у скелетних м'язах (від англ. muscle — м'язи).
Для лактатдегідрогенази характерні п'ять форм ізоферментів (НННН, НННМ, ННММ, НМММ, ММММ), які відповідно позначають: ЛДГ,, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ». Перші два ізоферменти (ЛДГХ і ЛДГ2) під час електрофорезу рухаються до анода і називаються анодними фракціями, останні два (ЛДГ4 і ЛДГЙ) рухаються до катода і називаються катодними фракціями. Ізофермент ЛДГ3 займає проміжне становище (проміжна фракція). Фракції відрізняються між собою біологічною дією. Так, анодні фракції здійснюють процеси перетворення піровиноградної кислоти в аеробних умовах, катодні — в анаеробних, а проміжна фракція — в аеробних і анаеробних умовах. Для кожного органа характерні свої ізоферменти. Наприклад, в серцевому м'язі, мозку, нирках і еритроцитах переважають ізоферменти ЛДГ, і ЛДГ2, які каталізують процес перетворення піровиноградної кислоти до оцтової. Ізоферменти ЛДГ4 і ЛДГВ характерні для скелетних м'язів, тканини печінки і легенів. Під впливом цих ізоферментів піровиноградна кислота перетворюється на молочну. Ізофермент ЛДГ, переважає в тканині селезінки і в деяких ендокринних залозах.
Залежно від віку, фізіологічного стану та інших факторів в організмі встановлюється певне співвідношення між різними ізоферментами, якому відповідає певний рівень активності ферменту в цілому. Зміна співвідношення ізоферментів в організмі має важливе значення в регуляції їх активності.
АКТИВНІСТЬ ФЕРМЕНТІВ
Характерною особливістю дії ферментів є їх висока каталітична активність. Вона значно вища, ніж неорганічних каталізаторів. Наприклад, пероксид водню розщеплюється на воду і кисень завдяки дії іонів заліза. Ця реакція каталізується також залізовмісним ферментом — каталазою. При цьому каталаза в 100 млн разів швидше розщеплює пероксид водню, ніж іони заліза. Високу каталітичну активність, порівняно з каталізаторами небіологічного походження, мають і інші ферменти.
Активність ферментів характеризується швидкістю хімічних реакцій, які вони каталізують. Якщо за певний час фермент каталізує значну кількість хімічних перетворень, то вважають, що він маєви-с >ку каталітичну активність. Часто її визначають за кількістю субстрату, який перетворюється за одиницю часу, або за кількістю продуктів реакції, які утворюються за цей час. Активність ферментів
визначають також, виходячи із залежності, яка при певних умовах існує між активністю ферменту і його концентрацією.
Активність ферментів виражають в одиницях, які називаються кагалами (скорочено кат.). Катал— це каталітична активність, яка здійснює хімічне перетворення 1 моль субстрату за 1 с. Один катал характеризує досить високу ферментативну активність, яка майже не зустрічається при звичайних умовах. Тому активність ферментів виражають у частках каталу, наприклад у мілікаталах (мл-кат.— одна тисячна частка каталу), в мікрокаталах (мк-кат.— одна мільйонна частка каталу) і т. д. Наприклад, у досліджуваній пробі ферментативна активність становить 2 мк-кат., тобто в пробі міститься така кількість ферменту, яка може здійснити перетворення 2 мкмоль субстрату за 1 с
У деяких випадках важливо знати не тільки, яка активність даного розчину, що містить фермент, а й яка ферментативна активність саме білка, що знаходиться в розчині. З цією метою в досліджуваному розчині визначають вміст білка і після цього роблять перерахунки, яка ферментативна активність одиниці маси білка, наприклад, 1 мг. Число одиниць ферменту, яке припадає на 1 мг білка ферментного препарату, називається питомою активністю. Чим ретельніше очищений фермент, тим вища його питома активність.
Користуючись одиницями активності ферментів, можна досить точно співставити активність різних препаратів одного і того самого ферменту. Однак, коли є потреба порівняти між собою активність різних ферментів, то використовують таку міру активності ферментів, як молекулярна активність. її раніше називали числом оборотів ферменту.
Молекулярна активність — це кількість молекул субстрату, яка перетворюється за одну хвилину однією молекулою ферменту. Для різних ферментів молекулярна активність також різна (табл. 14).
Із даних таблиці видно, що перше місце за активністю займає карбоангідраза, яка за 1 хв перетворює 36 млн молекул субстрату (вугільної кислоти). Це найактивніший (із усіх нині відомих) фермент.
Таблиця 14. Молекулярна активність деяких ферментів (за В. Й. Розенгартом)
Фермент
Число молекул субстрату.
що перетворюється однією
молекулою фррменту за
1 хв
Карбоангідраза 36 000 000
Кетостероїдізомсраза 17 100 000
Амілаза 1 100 000
Аиетилхолінестераза 3 000 000
р-Галактозида?а Е. соїі 12 500
Фосфоглюкомутаза 1240
Сукцинатдепдрогеназа 1150
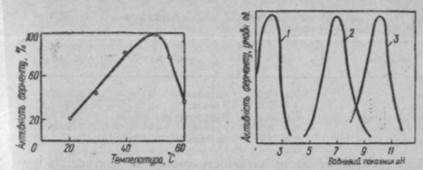
Рис. 54. Вплив температури на Рис. 55. Вплив рН середовища на активність
активність ферментів пепсину (/), амілази (2) і лужної фосфатази (3)
Вплив температури на активність ферментів. Ферменти—термолабільні речовини. Зміна температури зумовлює зміну їх активності. Так, підвищення температури на 10 °С прискорює швидкість хімічних реакцій приблизно в 2 рази. Однак ферменти є білками і підвищення їх каталітичної активності відбувається доти, поки не почнеться денатурація білка. Денатурація ферменту викликає руйнування його на-тивної структури, а це, в свою чергу, зумовлює втрату ферментативної активності.
