Определение факторов транскрипции во внутриядерном содержимом
Процедура получения фракции ядер интересующих клеток может быть следующей.
1. 5х106-2х107 клеток помещают в коническую пробирку объемом 15 мл, дважды отмывают в 10 мл фосфатно-солевого буфера (ФСБ) при 800 g 5-6 мин.
2. Супернатант удаляют и к осадку клеток добавляют гипотонический лизирующий буфер из расчета 0,5 мл буфера на 5х106 клеток. Ex temporo (не ранее, чем за 10 мин до добавления к клеткам) на 0,5 мл гипотонического буфера добавляют 5 мкл ингибиторов фосфатаз, 5 мкл ингибиторов протеаз, 5 мкл DTT (дитиотреитол), 0,5 мкл
PMSF.
3. Клетки аккуратно перемешивают в гипотоническом буфере, переносят в чистую пробирку объемом 1,5 мл и оставляют на льду в течение 10 мин.
4. Добавляют 25 мкл на 0,5 мл рабочего материала раствора детергента (0,1% SDS; 1% Triton X-100; 0,1% Tween 20) и перемешивают в течение 5 с.
5. Центрифугируют при 800 g 5-6 мин, 4 °С.
6. Супернатант отделяют (он содержит цитоплазматические белки и может представлять интерес для отдельного анализа), а осадок ядер ресуспендируют в 1 мл полного буфера для отмывки ядер (к буферу добавляют ex temporo 10 мкл ингибиторов фосфатаз, 10 мкл ингибиторов протеаз, 10 мкл раствора DTT, 1 мкл раствора PMSF).
7. Ядра дважды отмывают центрифугированием при 800 g 5-6 мин, 4 °С.
8. Осадок ядер по объему примерно равен 25 мкл. К этому осадку добавляют равный объем специальных экстрагирующих буферов и аккуратно перемешивают в течение 2 с.
9. Смесь инкубируют на льду в течение 30 мин, перемешивая каждые 10 мин.
10. Осветляют ядерный экстракт центрифугированием при 14 000 g 30 мин при 4 °С.
11. Супернатант содержит искомые вещества (факторы транскрипции). Его переносят в чистые охлажденные пробирки.
12. Определяют концентрацию белков по Bredford. Как правило, из 5х106 клеток удается получить 25-100 мкг ядерных белков.
13. Полученные образцы можно морозить при -80 °С в ожидании анализа, но только однократно.
Существуют технологии одновременного определения в одном биоматериале нескольких искомых факторов транскрипции (или цитокинов, или киназ и др.). Подобные методы в настоящее время осуществимы главным образом с применением высокотехнологичных коммерческих тест-систем. В качестве примера мы приведем описание процедур для тест-системы «Luminex 100» (Invitrogen. www.invitrogen.com). В данной технологии в качестве твердой фазы для ключевых реагентов используют микрошарики. Оценка результатов возможна только на уникальном приборе (большинство подобных тест-систем - так называемые закрытые, т.е. используют только свои приборы, свои реагенты, свои компьютерные программы).
Факторы транскрипции по своей природе реагируют, т.е. специфически связываются с определенными последовательностями нуклеотидов в двуспиральной ДНК.
Поэтому специфическими реагентами на факторы транскрипции являются строго определенные олигонуклеотиды ДНК, меченные биотином.
Второй олигонуклеотидный реагент конструируют из двух частей. Первая - последовательность нуклеотидов, комплементарная меченному биотином олигонуклеотиду. В виде двойной спирали они составляют сайт связывания искомого фактора транскрипции. Вторая часть этого олигонуклеотида - «ловушечная» последовательность, комплементарная последовательности нуклеотидов, фиксированной на твердой фазе (микрошариках).
Пробы раскапывают в лунки микропланшет, предназначенных для проведения ПЦР, чтобы использовать для инкубаций в качестве термостата термоциклер.
Минимальный набор анализируемых образцов включает:
• заведомо позитивный контроль;
• заведомо негативный контроль;
• пробу в виде постороннего белка;
• ядерный экстракт из нестимулированных клеток;
• ядерный экстракт из одноименных стимулированных клеток. Такой планшет инкубируют в течение 20 мин при 25 °С (можно в
ПЦР-термоциклере, который в данном случае используют как удобный динамичный термостат).
Затем в лунки с позитивным контрольным реагентом добавляют только буфер, тогда как в остальные лунки вносят буфер с нуклеазой, расщепляющей не связанную с белками ДНК. Инкубируют 20 мин при 37 °С. Только те ДНК-пробы, с которыми связались факторы транскрипции, не расщепляются нуклеазой, так как факторы транскрипции защищают последовательность нуклеотидов от атаки нуклеазы. Таким образом, количество биотиновой метки на молекулах ДНК прямо коррелирует с количеством того или иного фактора транскрипции в биопробе.
Стадия гибридизации с твердой фазой: в лунки вносят реагентные микрошарики и инкубируют 45 мин при комнатной температуре под светонепроницаемой крышкой, например, из алюминиевой фольги (рис. 4.14).
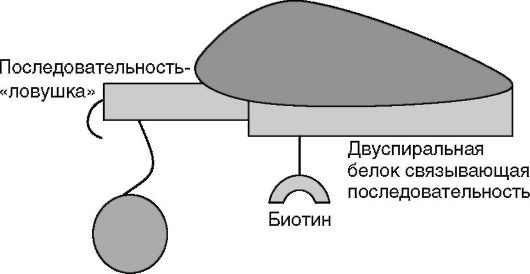 Рис. 4.14.Связывание с твердой фазой (шариками)
Рис. 4.14.Связывание с твердой фазой (шариками)
На следующей стадии (отмывке) применяют специальные планшеты из фильтрующего материала: содержимое лунок первоначальных планшет переносят в лунки планшет из фильтрующего материала и промывают трижды промывочным буфером с использованием вакуумной аспирации; растворимые компоненты вымываются, микрошарики остаются на дне лунок фильтровальных планшет.
Добавляют проявляющий реагент - конъюгат стрептавидина с люминофором, инкубируют 5 мин в темноте (рис. 4.15). Промывают и регистрируют люминесценцию на специальном приборе (например, Luminex 100).
Результаты считывают и обрабатывают специальной компьютерной программой (Luminex IS и др.).
В каждой биопробе за один цикл анализа, т.е. одновременно, можно количественно определить до 10 факторов транскрипции и более.
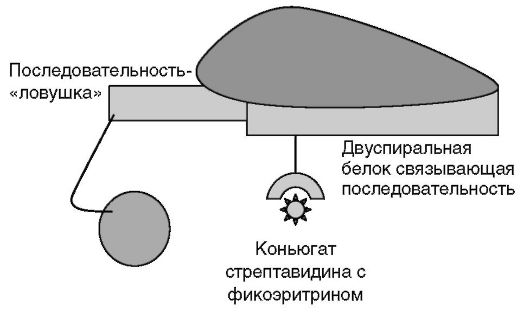 Рис. 4.15.Проявка
Рис. 4.15.Проявка
Вопросы и задания
1. Дайте определение термина «иммуноанализы».
2. Назовите варианты меток.
3. Назовите технологические варианты иммуноанализов.
4. Что такое «прямые» иммуноанализы?
5. Что такое «непрямые» иммуноанализы?
6. Какие вам известны варианты конструкций тест-систем?
7. Какие ферменты используют в иммуноферментных анализах?
8. Что такое иммунохроматография?
9. Что такое иммуноблот?
10. Дайте определение чувствительности и специфичности тестсистем.
11. Тест-системы с какими чувствительностью и специфичностью (высокой/низкой) следует применять в скрининговых (первичных) обследованиях?
12. Как зависит величина сигнала от концентрации определяемого вещества в биопробе в:
а) ловушечном;
б) конкурентном;
в) ингибиторном;
г) «сэндвич»;
д) иммунометрическом вариантах иммуноанализов.
13. Нарисуйте схему иммунометрической тест-системы.
14. Что означает вывод о «ложнопозитивном» результате иммуноанализа?
15. Что означает вывод о «ложнонегативном» результате иммуноанализа?
16. Какие варианты регистрирующих приборов применяют в иммуноанализах?
17. Какова в среднем чувствительность иммуноанализов (относительно концентраций определяемых веществ)?
Глава 5
Гибридомная технология. Моноклональные антитела.
В конце 60-х - начале 70-х годов XX в. были разработаны лабораторные методы клонирования клеток in vitro. Для этого понадобилось создать питательные среды, материалы для лабораторной посуды и термостаты-инкубаторы, позволившие имитировать условия внутренней среды организма для сохранения жизнеспособности клеток млекопитающих. В течение 10-12 лет удавалось клонировать только опухолевые клетки, поскольку их собственным свойством является способность неограниченно (в благоприятных для них внешних условиях) делиться митозом. Г. Келлер и Ц. Мильштейн в 1974-1975 гг. применили метод получения гибридных соматических клеток, который использовали цитогенетики для изучения локализации генов, контролирующих тот или иной признак в той или иной хромосоме (гибридные клетки выбрасывают большую часть хромосом, но не все), к лимфоцитам, но с иными целями. Г. Келлер и Ц. Мильштейн получили гибридные клетки из лимфоидной опухоли (миелома) и нормального лимфоцита. Гибридные клетки имели часть хромосом (а следовательно, и свойств) нормального лимфоцита (другая часть хромосом выбрасывалась из клеток в течение первых делений, пока геном не стабилизировался) и часть - от опухоли. Размножались только клетки, унаследовавшие от миеломы способность к неограниченному делению. Параллельно в них шел биосинтез тех или иных продуктов нормального лимфоцита, например антител; последние и требовались Г. Келлеру и Ц. Мильштейну. Неограниченно делящиеся клетки «позволяют» себя клонировать, т.е. физически «рассадить» по одной (каждую в отдельную посуду) и получить клоны клеток - потомков одной клетки. Такие клетки назвали гибридомами.
Лимфоциты для гибридизации получают из селезенки или лимфоузлов, предварительно иммунизированных целевым антигеном мышей (чаще всего - линии Balb/c). В качестве опухолевых клетокпартнеров используют специально выведенные для получения гибридом мутантные клетки мышиной миеломы (иногда ее же называют плазмоцитомой, что в данном случае одно и то же), полученные из перевивной линии миеломных клеток МОРС-21 от мышей Balb/c,
поддерживаемой в культуре in vitro с 1921 г. Келлер и Мильштейн использовали мутантные миеломные клетки, выведенные цитогенетиками ранее также для получения гибридных клеток млекопитающих, но в иных целях: поскольку гибридные клетки выкидывают большую часть хромосом, по оставшимся цитогенетики устанавливали локализацию тех или иных признаккодирующих генов в конкретных хромосомах.
«Мутантность» миеломных клеток необходима для метаболической селекции клеток гибридом от неслившихся с лимфоцитами клеток миеломы. Эта «мутантность» состоит в отсутствии в миеломных клетках действующего гена, кодирующего фермент ГГФРТ. Данный фермент катализирует синтез гуанина (одного из 4 азотистых оснований, входящих в состав ДНК) из гипоксантина. Вскоре после первой публикации Келлера и Мильштейна в распоряжении «гибридомщиков» во всем мире оказались две удобные линии мутантных миелом - P3/X63-Ag8-653 и SP2/0-Ag14, которые быстро пролиферируют и сами не продуцируют никаких частей иммуноглобулинов.
Суспензию лимфоидных клеток от иммунных мышей смешивают в одной пробирке в минимальном объеме среды с суспензией миеломных клеток и на 1-2 мин добавляют сливающий агент. У Келлера и Мильштейна сначала этим агентом был, как и у цитогенетиков, вирус Сендай, но через несколько месяцев уже все «гибридомщики» в качестве сливающего агента использовали синтетические полимеры - полиэтиленгликоли с молекулярными массами от 1540 до 6000 D. По прошествии 1-2 мин суспензию клеток, содержащую смесь неслившихся лимфоидных клеток, неслившихся клеток миеломы и гибридных клеток 3 вариантов («лимфоцит-лимфоцит», «миелома-миелома», «лимфоцит-миелома»; из них искомыми клетками являются только гибриды «лимфоцит-миелома»), отмывают и разводят в рассчитанном объеме селективной среды НАТ. НАТ означает «Hypoxanthine-Aminopterin Thymidine». Указанные 3 компонента в известных концентрациях вводят в полную культуральную среду. В течение первых 7-10 дней культивирования названной смеси клеток в культуре происходит следующее:
1) неслившиеся лимфоциты и гибриды «лимфоцит-лимфоцит» погибают в силу своей природной недолговечности;
2) неслившиеся клетки миеломы и гибриды «миелома-миелома» погибают от невозможности осуществлять биосинтез своей ДНК в присутствии аминоптерина - метаболического яда,
избирательно блокирующего ферменты биосинтеза пиримидиновых оснований de novo из N5N10-метилен-тетрагидрофолата; биосинтез пуриновых оснований из гипоксантина в этих клетках также невозможен в связи с отсутствием ГГФРТ; 3) единственные клетки, имеющие возможность выжить в среде НАТ, это искомые гибридные клетки «лимфоцит-миелома»: биосинтез пуриновых оснований у них обеспечен ГГФРТ, ген которой получен из нормального лимфоцита, и средовым гипоксантином, а биосинтез пиримидиновых оснований осуществляется из средового тимидина с участием тимидинкиназы. Основные этапы гибридомной технологии показаны на рис. 5.1. От клеток миеломы данные гибридные клетки наследуют свойство неограниченной пролиферации. От нормальных иммунных В-лимфоцитов - биосинтез иммуноглобулинов.
Пролиферация «non-stop» позволяет клонировать гибридные клетки, т.е. рассеять по 1 в лунку и подождать, когда из этой одной клетки при благоприятных условиях культивирования вырастет клон, т.е. много одинаковых клеток (с точностью до спонтанных мутаций). Какие из получившихся «лимфоцит-миеломных» гибридных клеток продуцируют заданные антитела, выясняют, отбирая из лунок пробы супернатанта на соответствующий иммуноанализ. В дальнейшем избранные гибридомы неоднократно реклонируют и выводят в массовые культуры - реакторы in vitro или асцитные опухоли у сингенных мышей. Из культуральных супернатантов или асцитных жидкостей выделяют гибридомные моноклональные антитела в очищенном виде.
Если клон клеток гибридомы синтезирует антитела, то эти антитела называют моноклональными. Как показал опыт, все клетки клонированной гибридомы синтезируют одинаковые антитела - и по специфичности активного центра, и по изотипу тяжелой цепи, т.е. моноклональные антитела - не только продукт моноклона, но и препарат одинаковых иммуноглобулинов. В конце 1970-х годов научились выращивать in vitro и клонировать Т-лимфоциты, не скрещенные с опухолевой линией клеток. Это стало возможным только после открытия фактора роста Т-лимфоцитов, позже названного ИЛ-2. Именно клонирование Т-лимфоцитов позволило открыть субпопуляции CD4+ Т-лимфоцитов и сделать множество других открытий, в том числе идентифицировать ВИЧ (достаточные для исследования количества генов и белков вируса смогли наработать
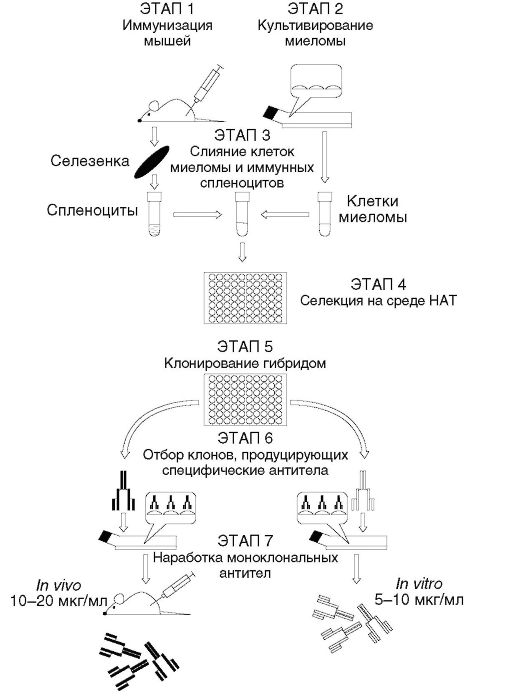 Рис. 5.1.Основные этапы получения гибридом
Рис. 5.1.Основные этапы получения гибридом
только на Т-лимфоцитах, культивируемых in vitro в присутствии факторов роста). В-лимфоциты без превращения их в гибридомы можно заставить делиться (что позволяет их клонировать), если инфицировать их вирусом Эпштейна-Барр (он трансформирует нормальные В-лимфоциты в опухоль из В-лимфоцитов).
Таким образом, моноклональные антитела, продуцируемые одним клоном, являются:
• высокоспецифичными, направленными к заданной антигенной детерминанте;
• идентичными по изотипу, аллотипу и идиотипу, а также по аффинитету и физико-химическим характеристикам.
Стабильные культуры гибридом способны продуцировать в неограниченном количестве моноклональные антитела.
Моноклональные антитела в настоящее время широко применяют в различных областях медицины.В основе применения монАТ в различных областях лежит возможность получения больших количеств высокоаффинных антител, специфичных по отношению:
1) к иммуногенным антигенам, определяющим гистосовместимость и дифференцировку;
2) дифференцировочным, опухолевым и другим антигенам клеточной поверхности, которые лишены полиморфизма и неиммуногенны в аллогенных системах, но распознаются при ксеногенной иммунизации;
3) вирусным и бактериальным антигенам;
4) единичным антигенным детерминантам разнообразных белков, нуклеиновых кислот и сахаров.
Применение монАТ позволяет определять и разделять субпопуляции клеток, различать отдельные стадии развития клеток, более точно типировать ткани, более точно идентифицировать микроорганизмы, а также более надежно определять иммунологическими методами биологически важные макромолекулы.
В медицине на основе монАТ разработано большое количество систем диагностирования различных заболеваний (инфекционных, онкологических и др.). Активно разрабатываются и лекарственные препараты на основе монАТ, например противоопухолевые препараты, антицитокиновые антитела (препарат ремикейт и др.) Однако было показано, что применение мышиных монАТ для иммунотерапии опухолевых заболеваний приводит к появлению различных побочных эффектов и отличается слабой эффективностью действия.
Модификация мышиных монАТ (гуманизированные антитела и различные конъюгаты монАТ - с радионуклидами, лекарствами, токсинами и пр.) открывает новые возможности в диагностике и лечении опухолевых и других заболеваний.
Глава 6. Генетическая методы исследования в иммунологии.
