Обробки рук медичного персоналу та використання медичних рукавичок
Питання для самоконтролю знань
1. Влаштування та призначення мікробіологічної лабораторії.
2. З яких структурних підрозділів складається лабораторія?
3. Санітарно - гігієнічні вимоги до лабораторної кімнати.
4. Обладнання лабораторії та робочого місця.
5. Правила роботи та техніка безпеки під час роботи в мікробіологічній лабораторії.
6. Складові частини мікроскопа.
7. Поняття про імерсійну систему мікроскопування.
8. Правила мікроскопування під імерсійною системою мікроскопа.
Обсяг самостійної роботи на занятті
Студенти знайомляться з влаштуванням і обладнанням мікробіологічної лабораторії, визначають основні санітарно-гігієнічні вимоги до приміщення, вивчають правила роботи в лабораторії і техніку безпеки при дослідженні заразного матеріалу.
Повторюють складові частини мікроскопа, вивчають правила мікроскопування мікропрепаратів під імерсійною системою, розглядають готові мікропрепарати.
Роблять записи основних положень у щоденник.
Перелік практичних навичок
1. Робота з мікроскопом.
Алгоритми виконання практичних навичок:
І. Правила роботи з імерсійною системою мікроскопа
1 .Підніміть конденсор до рівня предметного столика.
2. Відкрийте іріс-діафрагму.
3. Користуючись сухим об'єктивом х8, за допомогою плоского дзеркала, досягніть максимального освітлення поля зору.
4. Віднайдіть імерсійний об'єктив за його ознаками. Обертаючи «револьвер», надайте йому робочого положення.
5. Розмістіть на предметному столику мікропрепарат, нанесіть на нього краплю імерсійної речовини, закріпіть клемами
Імерсійною речовиною може бути:
- дистильована вода;
- різні види олій - кедрова, вазелінова, рицинова тощо.
Вибір імерсійної речовини залежить від виду об'єктива.
6. Під контролем зору опустіть імерсійний об'єктив у краплю
імерсійної рідини.
7. Обертаючи макрогвинт, знайдіть контури зображення.
8. За допомогою мікрогвинта досягніть максимальної чіткості.
9. Після закінчення роботи підніміть тубус, зніміть мікропрепарат, обережно витріть серветкою об'єктив, переведіть його у неробоче положення.
ІІ. Розгляд готових мікропрепаратів під імерсійною
системою мікроскопа
| Завдання | Вказівки до завдання |
| 1. Розгляньте готові мікропрепарати | 1.1 Розмістіть мікропрепарат на предметному столику 1.2. Промікроскопуйте під імерсійною системою 1.3. Замалюйте мікроскопічну картину у щоденник. |
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
для студентів до практичного заняття на тему:
Морфологія мікроорганізмів
Актуальність теми
Мікроорганізми - це найдрібніші живі істоти, невидимі неозброєним оком. У мікросвіті існує велика кількість різних форм, які різняться між собою морфологічними та біологічними особливостями.
Для визначення і дослідження морфології мікроорганізмів у заразному матеріалі застосовують мікроскопічний метод лабораторної діагностики.
З цією метою молодший медичний спеціаліст повинен володіти навичками виготовлення мікропрепарату, його фарбуванням простим або складним методами, мікроскопії під імерсійною системою і визначенням виду мікроорганізмів.
Навчальні цілі
Знати: ♦ Морфологію і тинкторіальні властивості мікроорганізмів
Вміти: ♦ Взяти матеріал для дослідження
♦ Виготовити мікропрепарат
♦ Забарвити препарат простим методом та за методом
Грама з модифікацією Синьова
♦ Трактувати результат мікроскопічного дослідження.
Матеріали доаудиторної самостійної підготовки студентів
Міждисциплінарна інтеграція
| №п/п | Назва дисципліни | Знати | Вміти |
| 1. | Біологія | Будову мікроскопа Порівняльну характеристику еукаріотів та прокаріотів Неклітинні форми життя | Працювати з мікроскопом |
| 2. | Основи екології | Проблеми забруднення навколишнього середовища | |
| 3. | Основи латинської мови | Терміноелементи Словотворення Грецькі еквіваленти | |
| 4. | Фізика | Процеси випаровування |
Орієнтовна карта самостійної роботи з літературою
| Завдання | Вказівки до завдання | Самостійні записи |
| 1. Ознайомтесь з: | 1.1. Класифікацією мікроорганізмів | |
| 2. Вивчіть: | 2.1. Основні форми бактерій 2.2. Коротку морфологічну характеристику грибів, спірохет, рикетсій, вірусів | |
| 3. Повторіть: | 3.1. Будову бактерійної клітини | |
| 4. Охарактеризуйте: | 4.1. Метод мікробіологічної діагностики, що вивчає морфологію мікроорганізмів | |
| 5. Опрацюйте: | 5.1 Техніку виготовлення мікропрепарату 5.2. Методи фарбування: простий фуксином та складний за Грамом з модифікацією Синьова | |
| 6. Ознайомтесь з: | 6.1. Методикою фарбування додаткових елементів клітини та кислото- спирто- і лугостійких бактерій |
Запитання для самоконтролю знань.
1. Якою класифікацією мікроорганізмів користуються на сьогоднішній день?
2. Які основні форми бактерій Ви знаєте?
3. Будова бактерійної клітини.
4. Метод лабораторної діагностики для вивчення морфології мікроорганізмів, його характеристика.
5. Коротка морфологічна характеристика грибів, спірохет, рикетсій, вірусів.
6. Опишіть представників мікроорганізмів тваринного походження.
7. Техніка виготовлення мікропрепарату, методи забарвлення мазків.
Обсяг самостійної роботи студентів на занятті
Студенти виготовляють мікропрепарат з досліджуваного матеріалу, фарбують його простим і складним методами (за Грамом з модифікацією Синьова), мікроскопують під імерсійною системою мікроскопа, вивчають основні форми мікроорганізмів; замальовують мікроскопічну картину у щоденник .Знайомляться з методикою фарбування мазків для виявлення спор. капсул, включень, кислото -, спирто- і лугостійких бактерій.
Перелік практичних навичок
1. Виготовлення мазків-препаратів
2. Забарвлення мазків різними методами
Алгоритми виконання практичних навичок:
І. Виготовлення мікропрепарату з досліджуваного матеріалу
| Завдання | Техніка виконання | Умови виконання |
| 1. Підготуйте необхідний інструментарій та матеріал | Пальник, предметне скло, бактеріологічну петлю, досліджуваний матеріал, сухе мило, марлеву серветку | |
| 2. Підготуйте предметне скло | 2.1. Натріть предметне скло сухим милом 2.2. Витріть марлевою серветкою | ●Скло вважається знежиреним, якщо крапля води, нанесена на нього, розтікається |
| 3. Запаліть пальник | ||
| 4. Виготовляйте мазок | 4.1. Візьміть предметне скло в ліву руку 4.2. Візьміть бактеріологічну петлю в праву руку 4.3. Зафламбуйте петлю у полум’ї пальника у вертикальному положенні 4.4. Нанесіть петлею на середину скла досліджуваний матеріал 4.5. Розітріть досліджуваний матеріал діаметром 1-2 см 4.6. Зафламбуйте петлю | ●Скельце тримайте пальцями за ребра ●Рідкий досліджуваний матеріал можна наносити також пастерівською піпеткою ●Якщо досліджуваний матеріал щільний, попередньо на предметне скло нанесіть петлею краплю фізіологічного розчину ● Мазок повинен бути тонким і рівномірним |
| 5. Висушіть мазок | 5.1. Мазок висушуйте при кімнатній температурі; якщо висушування затримується – у теплих шарах повітря над пальником | ●Не можна використовувати високу температуру -порушується структура мікробної клітини |
| 6. Зафіксуйте мазок | 6.1. Мазок тричі пронесіть через найгарячішу частину полум’я пальника | ●Мазок фіксують для: -закріплення матеріалу на склі; -знезараження; -вбиті мікроби краще поглинають барвники |
| 7. Зафарбуйте мазок | 7.1. Метод фарбування виберіть в залежності від властивостей мікроорганізмів |
ІІ. Фарбування мікропрепарату простим методом (фуксином)
1. На фіксований мазок нанесіть кілька крапель фуксину.
2. Витримайте 1-2 хвилини.
3. Фарбу злийте.
4. Мазок промийте ретельно водою.
5. Висушіть на повітрі або за допомогою фільтрувального паперу.
Мазок повинен бути повністю сухим, так як залишок води
утворює з імерсійною олією емульсію, що затруднює мікроскопування.
ІІІ. Фарбування препарату за методом Грама з модифікацією Синьова
І. На фіксований мазок накладіть фільтрувальний папір, просочений карболовим генціанвіолетом і нанесіть кілька крапель води на 1-2 хвилини.
2. Пінцетом зніміть папір, злийте фарбу і нанесіть розчин Люголя
на 1/2 - 1 хвилину (до повного почорніння).
3. Злийте розчин Люголя, налийте на мазок на 1/2 - 1 хвилини 96%розчин етилового спирту.
4. Препарат старанно промийте водою.
5. Нанесіть на препарат фуксин на 1-2 хвилини.
6. Злийте фарбу, промийте водою.
7. Висушіть препарат.
Препарат висушуйте на повітрі або з допомогою
фільтрувального паперу.
8. Мікроскопуйте під імерсійною системою мікроскопа.
ІV. Мікроскопування мікропрепарату під імерсійною системою мікроскопа
| Завдання | Вказівки до завдання |
| 1. Підготуйте до роботи мікроскоп | Правила підготовки мікроскопа і мікропрепарату див.у практичній роботі №1 |
| 2. Розгляньте під імерсійною системою виготовлений мікропрепарат | |
| 3. Зверніть увагу на форму, розміщення мікроорганізмів, фарбування за методом Грама | Користуйтесь знаннями морфології мікроорганізмів |
| 4. Визначіть вид мікроорганізмів | |
| 5. Замалюйте мікроскопічну картину у щоденник |
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
для студентів до практичного заняття на тему:
Фізіологія мікроорганізмів
Актуальність теми
Знання даної теми необхідні молодшому медичному спеціалісту з позицій більш глибокого розуміння різноманітних функцій мікроорганізмів.
У цій темі розкривається зв'язок хімічного складу, фізіологічних особливостей мікроорганізмів з їх будовою, значення цих ознак для лабораторної діагностики.
Вивчений матеріал дає можливість опрацювання техніки посіву досліджуваного матеріалу на живильні середовища, розуміння принципів його взяття і транспортування до лабораторії.
Навчальні цілі
Ознайомитись:♦ З поживними середовищами
Знати: ♦ Принципи культивування аеробних та анаеробних
мікроорганізмів
♦ Етапи виділення чистої культури мікроорганізмів
♦ Ідентифікацію чистих культур
Вміти: ♦Посіяти патологічний матеріал на живильні середовища
♦ Оцінити ріст мікроорганізмів на поживних середовищах
Матеріали доаудиторної самостійної підготовки студентів
Міждисциплінарна інтеграція
| №п/п | Назва дисципліни | Знати | Вміти |
| 1. | Основи екології | Проблеми забруднення навколишнього середовища | |
| 2. | Основи латинської мови | Терміноелементи Словотворення Грецькі еквіваленти | |
| 3. | Медична хімія | Водневий показник Осмотичний тиск Окисно-відновні реакції | |
| 4. | Англійська мова | Походження термінів | |
| 5. | Біологія | Будову мікроскопа Порівняльну характеристику еукаріотів та прокаріотів Неклітинні форми життя Хімічний склад клітини Ферменти Обмін речовин | Працювати з мікроскопом |
Вивчення даної теми пропонується для самостійної позааудиторної роботи студентів.
Програмний матеріал необхідно опрацювати, користуючись «Орієнтовною картою самостійного вивчення студентами навчальної літератури» (див. Методичні рекомендації для псрс з навчальної дисципліни «Мікробіологія»).
Обсяг самостійної роботи студентів на занятті
Студенти знайомляться з живильними середовищами. Опрацьовують техніку посіву досліджуваного матеріалу на живильні середовища бактеріологічною петлею, тампоном, шпателем.
Розглядають демонстраційний ріст мікроорганізмів на живильних середовищах. Вивчають принципи культивування аеробних та анаеробних мікроорганізмів; етапи виділення чистої культури; її ідентифікацію за морфотинкторіальними, культуральними, ферментативними, антигенними та іншими властивостями.
Мікробіологічний метод діагностикидає змогу ідентифікувати вид мікроорганізмів і є ведучим для встановлення діагнозу більшості інфекційних хвороб. Виділення чистої культури та її ідентифікацію проводять у декілька етапів:
1-й етап – посів досліджуваного матеріалу на поживні середовища з метою отримання ізольованих колоній;
2-й етап – оцінка характеру росту мікроорганізмів на поживних середовищах;
3-й етап – визначення морфології мікроорганізмів;
4-й етап – виділення чистої культури мікроорганізмів;
5-й етап – визначення ферментативних властивостей мікробів;
6-й етап – визначення точних маркерів мікроорганізмів: антигенної структури, фагочутливості, антибіотикограми тощо.
Перелік практичних навичок
1.Посів досліджуваного матеріалу на живильні середовища.
Загальні вимоги до проведення посівів досліджуваного матеріалу
1. Всі маніпуляції, пов’язані з посівом, проводять в асептичних умовах.
2. Необхідно ретельно виконувати правила техніки безпеки при роботі із заразним матеріалом та дотримуватись правил протипожежної безпеки.
3. Чашки Петрі з посівами підписують відповідно до Державних санітарних правил (ДСП 9.9.5.-080-02): на кришці – назва середовища і дата виготовлення;
на дні – номер аналізу, дата посіву, назва культури за бінарною номенклатурою.
Алгоритми виконання практичних навичок:
І. Посів бактеріологічною петлею на скошений агар
1. Запаліть пальник.
2. Візьміть у ліву руку між великим і вказівним пальцями пробірку із скошеним агаром.
3. У праву руку, як перо, візьміть бактеріологічну петлю.
4. Петлю зафламбуйте у полум’ї пальника у вертикальному положенні.
5. Внесіть її у посудину з досліджуваним матеріалом.
Обережно, щоб не торкнутись зовнішньої поверхні посудини
Петлю попередньо охолодіть, торкаючись внутрішньої
поверхні посудини.
6. Наберіть петлею досліджуваний матеріал.
7. Корок із пробірки вийміть правою рукою, затискаючи його між мізинцем і долонею.
Увага! Корки виймайте плавно, без ривків!
8. Зафламбуйте край пробірки.
9. Внесіть петлю з досліджуваним матеріалом у пробірку з середовищем.
Уважно, щоб не торкнутись зовнішньої поверхні пробірки!
10. Матеріал зигзагоподібними рухами розітріть на поверхні агару знизу догори.
Посів здійснюйте обережно, щоб не пошкодити поверхню
середовища.
11. Закрийте пробірку корком, одночасно фламбуючи край пробірки і корок над полум'ям пальника.
12. Пробірку поставте у штатив.
13. Петлю зафламбуйте, поставте у ємність.
ІІ. Посів тампоном у чашку Петрі
1. Візьміть чашку Петрі з середовищем у ліву руку.
2. Тампон візьміть у праву руку, як перо.
3. Злегка привідкрийте чашку Петрі.
4. Внесіть тампон з досліджуваним матеріалом.
Уважно, щоб не торкатись країв чашки Петрі!
5. Втирайте вміст тампона у поверхню середовища, обертаючи його навколо осі.
6. Чашку Петрі закрийте і переверніть дном вгору.
7. Тампон помістіть у пробірку або в лоток для відпрацьованого матеріалу.
Ш. Посів шпателем у чашку Петрі
1. Запаліть пальник.
2. Приготуйте шпатель.
3. Візьміть у ліву руку чашку Петрі.
4. У праву руку - бактеріологічну петлю.
5. Зафламбуйте її у полум'ї пальника у вертикальному положенні.
6. Наберіть петлею досліджуваний матеріал, внесіть у чашку Петрі
і розмістіть на поверхні живильного середовища біля краю чашки
Досліджуваний матеріал можна внести також пастерівською піпеткою.
7. Петлю зафламбуйте.
8. Візьміть шпатель у праву руку.
9. Внесіть його у чашку Петрі, злегка привідкривши її.
10. Поступальними рухами розітріть досліджуваний матеріал по поверхні середовища.
11. Вийміть шпатель, чашку закрийте і переверніть дном вгору.
12. Шпатель опустіть у дезінфектант.
IV. Посів бактеріологічною петлею
на рідке живильне середовище
І. Запаліть пальник.
2. Візьміть у ліву руку флакон (пробірку) з рідким живильним середовищем.
3. У праву руку візьміть бактеріологічну петлю, як перо.
4. Зафламбуйте її у полум’ї пальника у вертикальному положенні.
5. Наберіть досліджуваний матеріал за відомими Вам правилами.
6. Вийміть корок з флакона (пробірки) правою рукою, затискаючи
його між долонею і мізинцем.
Корок виймайте плавно, без різких рухів!
7. Край флакона (пробірки) зафламбуйте у полум'ї пальника.
8. Петлю погрузіть злегка у живильне середовище і розітріть посівний матеріал на стінці флакона (пробірки) на межі повітря і середовища.
Петлю вносьте уважно, щоб не торкатись країв флакона!
9. Змийте середовищем зроблений посів.
Обережно, щоб не замочити корок!
10. Вийміть петлю з флакона (пробірки).
11. Закрийте флакон (пробірку), одночасно фламбуючи його край і корок.
Працюйте з пальником уважно, щоб застерегтися від пожежі.
12. Петлю зафламбуйте, поставте у ємність.
V. Посів бактеріологічною петлею у чашку Петрі
1. Запаліть пальник.
2. Візьміть у ліву руку чашку Петрі.
3. У праву руку, як перо, бактеріологічну петлю.
4. Петлю зафламбуйте у полум’ї пальника у вертикальному положенні.
5. Наберіть досліджуваний матеріал за вище вказаними правилами.
6. Привідкрийте чашку Петрі.
7. Внесіть петлю з досліджуваним матеріалом біля краю чашки.
Уважно! Щоб не торкатись країв чашки!
8. Петлю вийміть, зафламбуйте.
9. Повторно внесіть петлю у чашку Петрі, горизонтально покладіть на поверхню агару, де був внесений досліджуваний матеріал.
10. Проведіть петлею кілька разів по поверхні середовища.
11. Потім зигзагоподібними рухами здійсніть посів досліджуваного матеріалу по поверхні середовища.
Штрихи повинні розташовуватись від краю до краю чашки
Петрі, близько один від одного. При посіві не пошкодьте
поверхню агару.
12. Петлю зафламбуйте, поставте у ємність.
13. Переверніть чашку Петрі дном вгору.
Орієнтовна карта спостереження
| Завдання | Самостійні записи |
| 1. Зверніть увагу на ріст мікроорганізмів на рідких та щільних середовищах | |
| 2. Спостерігайте за біохімічними властивостями мікроорганізмів на «строкатому ряду» Гісса | |
| 3. Зробіть записи та малюнки у щоденник для практичних занять |
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
для студентів до практичного заняття на тему:
Мікроби і навколишнє середовище
Актуальність теми
Екологія мікроорганізмів з кожним роком набуває все більшого значення. Значну цікавість має вивчення впливу фізичних, хімічних і біологічних факторів на патогенні і умовно-патогенні мікроби. Тема має велике практичне значення у роботі молодшого медичного спеціаліста, якому необхідні чіткі і повні знання правил асептики й антисептики, методів стерилізації і дезінфекції. Порушення цих важливих вимог, породжує важкі ускладнення, поширення інфекційних хвороб, виникнення нозокоміальних інфекцій. Сучасна медицина у своїй практичній діяльності не може нехтувати вимогами щодо боротьби з мікросвітом - використовує наявні і шукає нові методи та засоби впливу на мікроорганізми.
Навчальні цілі
Знати: ♦Застосування дезінфекції та стерилізації
Вміти: ♦Здійснювати дезінфекцію інфікованого матеріалу, робочого
місця тощо.
♦Проводити стерилізацію медичних інструментів,
перев’язного матеріалу, лабораторного посуду, живильних
середовищ.
Матеріали доаудиторної самостійної підготовки студентів
Міждисциплінарна інтеграція
| №п/п | Назва дисципліни | Знати | Вміти |
| 1. | Основи екології | Проблеми забруднення навколишнього середовища | |
| 2. | Основи латинської мови | Терміноелементи Словотворення Грецькі еквіваленти | |
| 3. | Англійська мова | Походження термінів | |
| 4. | Медична хімія | Водневий показник Осмотичний тиск Окисно-відновні реакції | |
| 5. | Біологія | Неклітинні форми життя Хімічний склад клітини Ферменти Обмін речовин | |
| 6. | Основи медсестринства | Дезінфекцію, стерилізацію Асептику, антисептику | Проводити дезінфекцію та стерилізацію чинників навколишнього середовища, інструментарію, перев’язного матеріалу |
| 7. | Фармакологія | Дезінфікуючі засоби Антисептичні середники | Застосовувати дезінфектанти та антисептичні засоби в залежності від механізму їх дії |
Орієнтовна карта самостійної роботи з літературою
| Завдання | Вказівки до завдання | Самостійні записи |
| 1. Ознайомтесь з: | 1.1. Поширенням мікробів у природі 1.2. Взаємодією мікробів у навколишньому середовищі | |
| 2. Отримайте: | 2.1. Поняття про асептику та антисептику | |
| 3. Закріпіть знання з питань: | 3.1. Дотримання протиепідемічних заходів у лікувальних установах 3.2. Вплив фізичних, хімічних та біологічних чинників на мікроби 3.3. Дезінфекція, стерилізація 3.4. Контроль за якістю стерилізації |
Вивчення питань «Мікрофлора організму людини», «Санітарно – показові мікроорганізми довкілля, лікарняних установ» з даної теми запропоновані для самостійної позааудиторної роботи студентів.
Програмний матеріал необхідно опрацювати, користуючись «Орієнтовною картою самостійного вивчення студентами навчальної літератури» (див. Методичні рекомендації для псрс з навчальної дисципліни «Мікробіологія») та представити виконані завдання.
Завдання для самоконтролю знань
1. Поширення мікробів у природі:
● грунті
● воді
● повітрі
2. Нормальна мікрофлора людського організму.
3. Поняття про асептику й антисептику.
4. Вплив фізичних факторів на мікроби, їх значення у медицині.
5. Вплив хімічних чинників на мікроорганізми, застосування у практичній медицині.
6. Вплив біологічних чинників на мікроби.
7. Що таке дезінфекція? Її види.
8. Стерилізація. Які існують види стерилізації?
9. Як проводять контроль якості стерилізації?
Обсяг самостійної роботи студентів на занятті
Студенти вивчають види дезінфекції, стерилізації. Закріплюють знання з методів стерилізації медичного інструментарію, перев'язного матеріалу, лабораторного посуду, живильних середовищ. Проводять дезінфекцію рук, робочого місця, патологічного матеріалу, здійснюють контроль за якістю стерилізації.
Перелік практичних навичок
1. Проведення дезінфекції.
2. Стерилізація медичного інструментарію, перев'язного матеріалу, лабораторного посуду, живильних середовищ.
3. Контроль якості стерилізації.
Алгоритми виконання практичних навичок:
І. Стерилізація медичного інструментарію
Медичний інструментарій багаторазового користування після використання:
● замочують у дезінфікуючий розчин*
● промивають під протічною водою
● висушують
● складають у бікси
● оформляють супровідну документацію
● відправляють у стерилізаційну
● у стерилізаційній здають під розписку
У стерилізаційній після реєстрації:
● інструментарій кип'ятять у 2% розчині натрію гідрокарбонату 15хв.
● замочують у миючий розчин при температурі 50-52°С на 15-20 хв.
● у миючому розчині ретельно миють щітками, йоршиками
● промивають під протічною водою
● роблять проби на залишки миючого засобу та приховану кров -
● кип'ятять у дистильованій воді 5хв. з метою знесолення
● висушують
● загортають у папір, тканину або вміщують у крафт-пакети і складають у бікси
● автоклавують при тиску 2 атм., 20 хв. або стерилізують у сухожаровій шафі при температурі 180°С 1годину.
*3астосування дезінфектантів регламентується методичними вказівками (рекомендаціями) МОЗ України, затвердженими головним санітарним лікарем України або інструкціями, прикладеними до ліцензованих засобів.
II. Стерилізація перев'язного матеріалу
Ватні кульки, марлеві серветки вкладають у полотняні мішечки або зв'язують у марлеву серветку, складають у бікс. Стерилізують в автоклаві при тиску 2атм 20хв.
Ш. Стерилізація живильних середовищ
Живильні середовища готують, розливають у стерильні чашки Петрі, пробірки, флакони, складають у бікси.
Парою під тиском (автоклавуванням) стерилізують різні живильні середовища (крім тих, які містять білок), рідини (фізіологічний розчин, воду та інші).
Режим стерилізації визначається їх складом і вказаний у рецепті виготовлення живильних середовищ.
Найбільш вживані живильні середовища (МПА, МПБ) стерилізують 20хв. при тиску 1атм (120°С).
Середовища з вуглеводами стерилізують у автоклаві 10-15хв. при тиску 0,5атм (112°С) або дробно: текучою парою при температурі 100°С протягом 30хв. 3дні підряд.
Різні рідини стерилізують 20хв. при тиску 1атм. (120°С).
Живильні середовища, які містять сечовину, вуглеводи, молоко, картоплю, желатину, стерилізують текучою парою. Застосовують метод роздрібної стерилізації: прогрівання проводять 3 дні підряд при температурі 100°С протягом 30-60хв.
При першому прогріванні гинуть вегетативні форми мікроорганізмів, а спорові зберігаються. Через 24 години спори проростають у вегетативні форми, які гинуть на другий день стерилізації. На третій день проводять завершальну стерилізацію.
Білкові рідини стерилізують на водяній бані або у спеціальних приладах з терморегуляторами при температурі 56-58°С протягом 1години 5днів підряд. Такий метод називається тіндалізація.
Живильні середовища, які містять білок, сироватку, деякі антибіотики, стерилізують методом фільтрації через бактеріальні фільтри.
ІV. Стерилізація лабораторного посуду
Лабораторний посуд (чашки Петрі, піпетки градуйовані і пастерівські, флакони, колби, пробірки) перед стерилізацією знезаражують, ретельно миють
і висушують.
1. Чашки Петрі загортають у папір по одній або кілька штук; при наявності складають у спеціальні металеві пенали.
2. Широкий кінець градуйованої піпетки закривають ватою, загортають у довгі смужки паперу шириною 4-5см. На папері відзначають об'єм загорнутої піпетки. Гострі кінці пастерівських піпеток запаюють у полум'ї пальника, отвір протилежного кінця закривають ватою, загортають у папір по
10 - 15 шт.
Загортати треба уважно, щоб не зламати кінці капілярів!
4. Флакони, колби, пробірки закривають ватно-марлевими корками.
Поверх корків (крім пробірок) надягають паперовий ковпачок. Пробірки зв'язують по 5-30 шт. і загортають у папір. Корки повинні входити у колби, флакони на 2/3 своєї довжини не досить вільно, але і не досить щільно!
Стерилізують лабораторний посуд у сухожаровій шафі (печі Пастера) при температурі 160 - 165°С 1 годину.
Загорнутий у папір посуд зберігається стерильним протягом 3 діб. Не загорнутий - необхідно використати протягом доби.
Стерилізацію у біксах проводять з відкритими отворами
!
V. Контроль якості стерилізації
Для контролю якості стерилізації в автоклаві використовують:
● бензойну кислоту з фуксином
● сірку
● антипірин
● сечовину
● фенацетин
Для контролю якості стерилізації у сухожаровій шафі:
● сахарозу
● тіосечовину
● альбуцид
VІ. Знезараження та утилізація гострокінцевих виробів медичного призначення одноразового використання
Гострокінцеві вироби медичного призначення після використання є потенційно небезпечними щодо можливості інфікування вірусними гепатитами В, С, ВІЛ, збудниками інших інфекцій з парентеральним механізмом передачі і підлягають обов’язковому знезараженню.
1. Після використання вироби попередньо 2 -3 рази промивають у дезінфектанті, набираючи його через голку (знімати голки категорично забороняється).
2. Набирають дезінфектант у шприц, системи для трансфузій розрізають на окремі частини і вироби повністю занурюють у дезінфектант.
Вироби, що знезаражуються, повинні знаходитись у тісному контакті з дезінфектантом (не бути оточеними повітрям і не містити пухирців повітря).
Не підлягають знезараженню ковпачки шприців.
3. Ємкості для приготування дезінфектантів повинні бути з матеріалу, який не б’ється. Перед повторним знезараженням ємкості ретельно миють.
4. Збір частин виробів після знезараження проводиться у використану картонну тару, саморобні картонні контейнери тощо.
5. Голки після знезараження знімають, поміщають у використану скляну або пластикову тару.
Знезаражені медичні вироби здаються особам, відповідальним за збір
6. Для знезараження використовуються розчини дезінфектантів, в режимах дезінфекції, встановлених діючими директивними документами:
накази МОЗ України від 22.10.1993р. №223 «Про збір, знезараження використаних медичних виробів одноразового призначення», від 25.05.2000р. №120 «Про вдосконалення медичної допомоги хворим на
ВІЛ – інфекцію/СНІД», Державним реєстром деззасобів, дозволених до використання в Україні станом на 30.07.2007р.(технічні регламенти використання деззасобів).
7. Для знезараження виробів сильно забруднених кров’ю, необхідно використовувати дезінфектанти нового покоління, які ефективно діють в умовах білкового навантаження.
8. Після знезараження вироби медичного призначення повинні зберігатись у приміщенні, яке має обмежений доступ.
9. Використаний дезінфектант розводять водою у співвідношенні 1:10 і зливають у каналізацію.
Утилізація виробів медичного призначення проводиться:
1. Шляхом заключення угод з підприємствами різних форм власності на утилізацію виробів.
2. Спалювання у спеціалізованих печах при t -180ºС (найбільш оптималь-ний варіант) – спалювання у спеціалізованих печах можна проводити у містах і районах, де є підприємства, які використовують ці печі або у печах підприємств, які виробляють цеглу тощо.
3. Відкрите спалювання або спалювання у металевих бочках – проводиться на відкритих місцях за узгодженням з територіальними органами охорони навколишнього середовища та санепідслужби. Для відкритого спалювання необхідна яма глибиною не менше 1,0м, після спалювання її засипають землею.
4. Захоронення без спалювання – утилізація проводиться на огородженій території у ямі глибиною не менше 2,0м. Вироби засипають прошарком землі товщиною 30см. Після заповнення яма заливається бетоном. Допускається захоронення на полігонах твердих побутових відходів, умови захоронення узгоджуються з територіальними СЕС.
*Алгоритм дії підготований епідвідділом облСЕС на основі наказів МОЗ України від 22.10.1993р. №223 «Про збір, знезараження використаних медичних виробів одноразового призначення», від 25.05.2000р. №120 «Про вдосконалення медичної допомоги хворим на ВІЛ – інфекцію/СНІД», Державного реєстру деззасобів, дозволених до використання в Україні станом на 30.07.2007р., матеріалів РАТН «Правильне використання і утилізація само руйнівних шприців та безпечних контейнерів», травень 2002р.
VІІ. Обробка рук медичного персоналу
| МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ'Я УКРАЇНИ НАКАЗ N 181 від 04.04.2008 м.Київ | Додаток до розділу 6 методичних рекомендацій “Епідеміологічний нагляд за інфекціями області хірургічного втручання та їх профілактика ” |
Методика
обробки рук медичного персоналу та використання медичних рукавичок
Руки медичного персоналу – один з основних факторів передавання збудників інфекційних хвороб в області хірургічних втручань. Дотримання медичним персоналом правил і техніки миття та антисептики рук, використання рукавичок дозволить попередити виникнення значної кількості захворювань, а також сприятиме раціональному використанню коштів.
Заходи щодо вдосконалення гігієни рук, у тому числі з використанням рукавичок, є невід'ємною складовою інфекційного контролю, а також пріоритетними у фінансуванні діяльності закладів охорони здоров’я.
Деконтамінація рук медичного персоналу досягається шляхом миття рук, обробки шкіри рук антисептиками, хірургічної антисептики.
З метою профілактики передачі інфекції через руки, важливим заходом є забезпечення хірургічних стаціонарів водопровідними кранами з механізмом ліктьового способу приведення в дію.
1. Для миття рук використовують рідке мило в дозаторах.
2. При застосуванні рідкого мила, дозатори багаторазового використання необхідно ретельно промити після закінчення в них мила, висушити і потім заповнити новою порцією мила. Не допускається додавати рідке мило в частково заповнений дозатор.
3. Показання для гігієнічного миття рук:
♦перед і після фізичного контакту з пацієнтом;
♦після відвідування туалету;
♦перед приготуванням і роздачею їжі;
♦у всіх випадках, коли руки явно забруднені.
4. Техніка миття рук (малюнок):
4.1. Зняти всі прикраси, у тому числі годинники та браслети;
4.2. Відкрити кран і струменевим потоком комфортно теплої води змочити руки;
4.3. Нанести порцію рідкого мила;
4.4. Енергійно терти руки протягом не менше 30 секунд за такою технікою:
♦терти долоня об долоню;
♦зовнішню сторону долонь спочатку правою рукою, а потім лівою;
♦схрестивши пальці однієї руки з іншою, терти між пальцями;
♦далі однією рукою накривають іншу руку „замком” і необхідно терти в п’ясно-фаланговій зоні, спочатку однієї руки, потім іншої;
♦енергійно терти круговими рухами великі пальці обох рук;
♦кінчиками пальців правої руки терти долоню лівої руки і навпаки.
4.5. Ретельно змити мило під протічною водою.
4.6. Насухо витерти руки рушником (серветкою).
4.7. Якщо крани без ліктьового способу приведення в дію, їх закривають сухим рушником (серветкою), який викидають у смітник, призначений для збору паперових рушників, який має бути розташований поруч.
4.8. Якщо після миття рук застосовують їх обробку антисептиком, то антисептик наносять лише на ретельно висушені руки.
5. Якщо в процесі роботи руки не забруднені біологічним матеріалом або брудом, миття рук можна замінити гігієнічною антисептикою.
6. Показання для гігієнічної антисептики рук:
♦перед та після проведення маніпуляцій, пов’язаних з можливим та явним пошкодженням шкіри та слизових оболонок пацієнта (обробка пуповинної рани, ін’єкції, установлення катетерів та зондів тощо);
♦перед та після контакту з рановими поверхнями, інфікованими ранами;
♦при контакті з стерильним матеріалом та інструментарієм;
♦після контактів з біосубстратами хворого (кров, ліквор, сеча та ін.);
♦після контакту з абіогенними об’єктами, потенційно контамінованими госпітальною мікрофлорою (прилади, катетери, зонди та ін. після їх використання);
♦при догляді за пацієнтами, коли необхідно після обробки забруднених місць перейти до чистих;
♦перед і після надягання медичних рукавичок;
♦перед виходом з палати.
7. Для антисептики шкіри рук використовують антисептики, зареєстровані в Україні. Можливе застосування суміші 70%розчинуетилового спирту з 1-2% вмістом гліцерину.
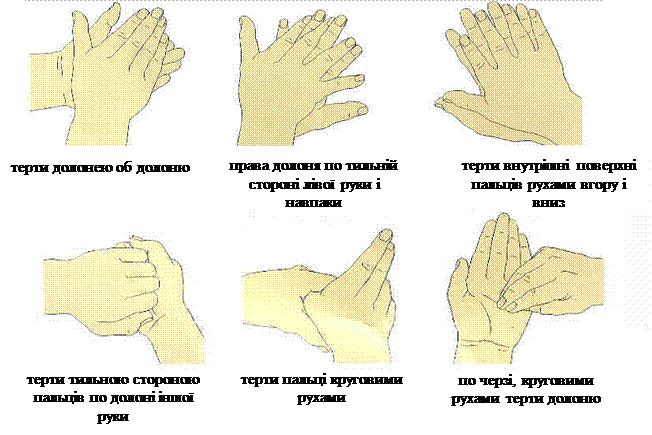 Техніка миття рук:
Техніка миття рук:
8. Техніка гігієнічної антисептики рук
1. На долоню нанести 3-5 мл антисептика або ту кількість, що зазначена в інструкції щодо застосування антисептика;
2. Енергійно втирати до повного висихання антисептик за технікою, представленою в пункті 4 цього додатка, але не менше 15 секунд;
3. Витирання або висушування рук не допускається.
