ТЕМА: Вивчення властивостей білків і їх визначення.
Дослід 10.1 Визначення ізоелектричної точки білків.
Принцип методу.
Визначення ізоелектричної точки білків грунтується на здатності
білків легко осаджуватися під дією осаджувачів, які спричинюють
дегідратацію білків, і за значення рН середовища, що відповідає їх
ізоелектричній точці. Розчин казеїну та желатину (1%), 0.01, 0.1 і 1
моль\л розчини оцтової
кислоти, 0.1 моль\л розчин ацетату натрію, 96% етиловий спирт (чи 95%
ацетон), дистильована вода.
Обладнання.
Скляні палички, пробірки, градуйовані піпетки, штатив для пробірок.
Визначення ізоелектричної точки казеїну.
На відміну від інших білків, казеїн осаджується в ізоелектричній точці
без дегідратуючих засобів. Ізоелектрична точка казеїну відповідає
рН 4,7.
Таблиця 2.
Співвідношення компонентів реакційної суміші (мл) для визначення ізоелектричної точки казеїну.
| вода | СН3СООН (0.01 моль/л) | СН3СООН (0.1 моль/л) | Розчин казеіну (1%) | рН середовища |
| 8,4 | 0,6 | ¾ | 1,0 | 5,9 |
| 7,8 | 1,3 | ¾ | 1,0 | 5,6 |
| 8,8 | ¾ | 0,3 | 1,0 | 5,3 |
| 8,5 | ¾ | 0,5 | 1,0 | 5,0 |
| 8,0 | ¾ | 1,0 | 1,0 | 4,7 |
| 7,0 | ¾ | 2,0 | 1,0 | 4,4 |
| 8,0 | ¾ | 4,0 | 1,0 | 4,1 |
| 1,0 | ¾ | 8,0 | 1,0 | 3,8 |
Хід роботи.
Беруть вісім пробірок. У кожну наливають воду, розчини оцтової кислоти та казеїну в співвідношеннях, які наведені в таблиці 2. Ізоелектричну точку казеїну визначають за максимальним ступенем помутніння (рН 4.7).
Визначення ізоелектричиої точки желатину.
Хід роботи.
В шість пробірок додають відповідну кількість (мл) розчинів оцтової кислоти, ацетату натрію, дистильованої води та желатину (табл 3). Вміст кожної пробірки перемішують. Потім у всі пробірки повільно по стінці доливають по 2 мл спирту (ацетон). Через ЗО хв визначають ізоелектричну точку, тобто знаходять пробірку з максимальним ступенем помутніння розчину.
Таблиця 3.
Співвідношення компонентів реакційної суміші (мл) для визначення ізоелектричної точки желатину.
| Вода | СН3СООН (0,1 моль) | СН3СООН (1моль/л) | СН3СООНNа 0,1моль/л | Розчину желатину (1%) | рН середовища |
| 3,8 | 0,8 | ¾ | 2,0 | 2,0 | 5,6 |
| 3,5 | 0,5 | ¾ | 2,0 | 2,0 | 5,3 |
| 3,0 | 1,0 | ¾ | 2,0 | 2,0 | 5,0 |
| 2,0 | 2,0 | ¾ | 2,0 | 2,0 | 4,7 |
| ¾ | 4,0 | ¾ | 2,0 | 2,0 | 4,4 |
| 3,8 | ¾ | 0,8 | 2,0 | 2,0 | 4,1 |
Дослід 10.2 Якісна реакція на пептидні зв'язки з нінгідрином.
Принцип методу.В результаті взємодії a-амінокислоти з нінгідрином (трикетогідринденгідратом) утворюється забарвлена комплексна сполука. Під час нагрівання (до температури 70° С) a-амінокислоти окислюються нінгідрином та піддаються окисному дезамінуванню з утворенням альдегіду і С02, а нінгідрин відновлюється:
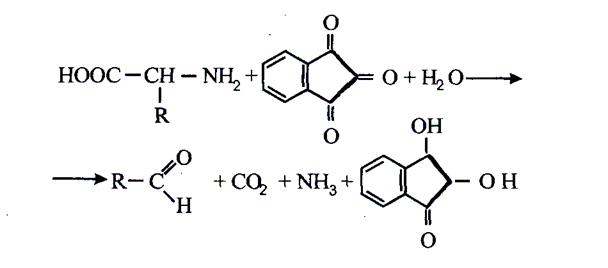
Відновлений нінгідрин, що конденсується з аміаком і окисленим нінгідрином, утворює сполуку, яка, енолізуючись, переходить у забарвлену форму синьо-фіолетового кольору:
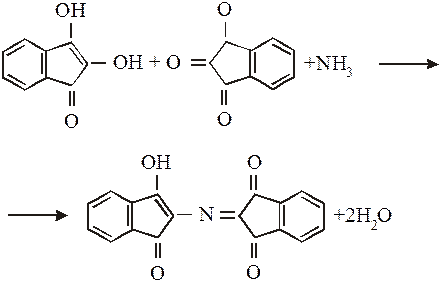
За наявності органічних розчинників, на яких готують розчин нінгідрину (ацетон, етанол), можливий перебіг побічної реакції з утворенням сполуки, яка містить радикал (R.) амінокислоти:
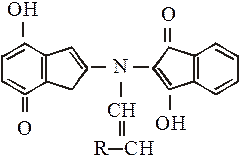
Наявність радикалу амінокислоти в складі цієї сполуки зумовлює різне забарвлення (червоне, жовте, блакитне) сполук, які утворюються під час реакції амінокислот із нінгідрином.
Реакція з нінгідрином є специфічною для амінокислот, що містять
a-аміногрупу, та характерною для деяких карбонових і циклічних амінокислот. У реакції гліцину з нінгідрином утворюється комплексна сполука синьо-фіолетового забарвлення
.
А. Хід роботи.
