Пептидазалар (пептидгидролазалар) 1 страница
Алматы, 2014
УДК 577.1 (075.8)
ББК 28.072 я 73
Б43
Пікір жазғандар:
А.Н.НұрмұхамбетовС.Д.Асфендияров атындағы ҚазҰМУдың
пат. физиология кафедрасының
профессоры,м.ғ.д.
С.А. Искаковаб.ғ.д., Орталық клиникалық ауруханадағы
инновация және білім беру МО ПЖБ
орталығының маманы
Б-43 К.О.Шарипов, А.Е.Есімжан, М.С. Байбулова. Энзимология негіздері:Оқу құралы. -Алматы. – 2014., ИП «Отан»- бет.
«Энзимология негіздері»оқу құралы Қазақстан Республикасының медициналық жоғары оқу орындарыныңстуденттерінебиологиялық химияға арналған Типтік бағдарламаның негізінде жасалған. Оқу құралыбасқа да биохимияны оқитын жоғары және орта буын медициналық мамандықтарын меңгеретін төменгі курс студенттерімен бірге ауылшаруашылық, малдәрігерлік, биологиялық, тағам дайындау технологиясы университеттерінің студенттеріне де пайдалануға ұсынылады.Оқу құралында ферменттер туралы толық теориялық мәліметтер берілген және квантталған текстер мен соларға сай тестер де берілген.
ББК 28.072 я 73
Медициналық жоғары оқу орындарына арналған оқу құралы С.Ж.Асфендияров атындағы Қазақ Ұлттық университетінің әдістемелік кеңесінде баспадан шығаруға ұсынылды.
№ хаттама « »қазан 2014жыл
© К.О, Шарипов.2014 год
©А.Е.Есімжан.2014 год
©М.С.Байбулова.2014
©ЖҚ «Отан», 2014
КІРІСПЕ
«Энзимология негіздері» оқу құралы биохимияның ең негізгі бөлімі- ферменттер туралы ғылымға арналған. Ерте заманда,мәдени дамудың бас-тапқы кезіндеақ адамдарөздерінің тіршілік әрекеттерінде әртүрлі фермен-тативтік процестерді кездестіріп, оларды өздерінің керекті мақсаттарына жұмсады. Ферменттердің негізін білу- жалпы биологиялық білім алудың қажетті элементтеріне жатады, оларды оқып білу кәзіргі дәрігерлердің ғы-лыми ойлану жүйесін құруға, тәжірибеде қалыптасқан білімді қолдана білуге және дағдылануға көмектеседі.
Бұл оқу құралы медициналық университеттердің студенттеріне арналған. Ол Қазақстан республикасының денсаулық сақтау министрлігі бекіткен жоғары медициналық оқу орындары үшін биохимия пәнінің бағдарламасына сәйкес құралған.
Оқу құралында ферменттер туралы кәзіргі заманға сәйкес толық мәліметтер берілген: ферменттердің жалпы қасиеттері, жіктелуі және номен-клатурасы, әсер ету механизмімдері, олардың активтенуі және тежелуі туралы теориялық негіздер берілген. Соныен қатар ферменттердің бұзылуынан туған аурулар мен ферменттердің қолданылуы туралы мәліметтер де қамтылып жазылған.
«Энзимология негіздері» оқу құралының жетекші идеясы – энзимоло-гия негіздерітарауында жаңа технологиялық тапсырмалар мен оқулық ма-териалдарын квантталған текстер мен тесттер түрінде жасап және қолдануға ыңғайлы тәсілде беру. Оқулық текстерінің квантталуы, яғни олардың қыс-қартылып, кішкене бөліктерге бөлінуі, сол әрбір кванттағымәліметтерді студенттің меңгеруіне жеңілдік туғызады. Олар түсіну, меңгеру және оны жағдаятты жағдайларға қолдана білу сатыларынан тұрады. Мұндай тап-сырмаларды жүйелі түрде орындау, келешек дәрігер-студентке өзінің жеке білім жүйесін қалыптастыруға жетелейді, ешкімнің күштеуінсіз, жеке қар-қынмен, жеңіл тапсырмалардан күрделілеріне ауысуға мүмкіндік береді, қойған мақсатына жетуде өзіндік шешім қабылдап, соған жетуге, тапқырлық, іскерлік көрсетуге бейімдейді. Кейінгі кезде оқулық текстерін кванттау-“head lines”- оқу үрдісін дамытудың маңызды түріне айналып келеді. Ол квантталған текстерді түсіну, тест тұрінде берілген сұрақтарды дұрыс мең-геру, алынған білімді клиникалық жағдаяттарға немесе клиникалық- тео-риялық жағдаяттарға қолдана білу(cases) үшін маңызды орын алып отыр.
Оқу құралы алғы сөзден, кіріспеден, ХV тараудан және қолданылған әдебиеттерден тұрады. Оқулық материалында 25 текстер жазылып,ол абзацтарға бөлінген, әр абзацқа тестік тапсырмалар берілген. Тестік тапсырмалардың жауаптары оқу құралының соңында берілген.
2 ТАРАУ ЭНЗИМОЛОГИЯ НЕГІЗДЕРІ
Ферменттер (ЭНЗИМДЕР): ҚҰРЫЛЫСЫ, қасиеттері, жіктелуі, номенклатурасы. МЕТАБОЛИЗМ ПРОЦЕССТЕРІН РЕТТЕУІ.
2.1. Ферменттер (ЭНЗИМДЕР) - табиғаты белоктық заттар болып келетін биологиялық катализаторлар, олар тірі ағзалардағы биохимиялық реакцияларды жылдамдатады. Белоктарға тән барлық қасиеттерге ие, сонымен қатар каталитикалық қасиеттерді білдіретін құрылымдық ерекшеліктерге ие.
«Фермент» термині латындық « fermentum»-ашытқы деген сөзден шыққан, cпирттік ашуға әсер ететін қосылыс. Ағылшын тілді әдебиетте «энзим» термині қолданылады, ол грек тілінде «enzyme» деген, көмірсулар ашуына қатысатын қосылыстар.
Ферменттер (Е) катализдің жалпы заңдарына бағынады және биологиялық емес катализаторларға тән қасиеттерге ие.
Энзимология –ферменттердін құрылысын, каталитикалық қасиеттерін, әсер ету механизмін және in vivoбелсенділігін реттеу ерекшелігін зерттейтін ( ғылым) биохимия ның бір тарауы.
2.2. Ферменттердің әсер ету жағынан бейорганикалық катализаторлармен ұқсастықтары:
* олар энергетикалық мүмкіндігі бар реакцияларды ғана тездетеді; яғни олардын қатысуынсыз да жүретін реакцияларды катализдейді;
*олар қайтымды реакциялардың тепе- теңдігін өзгертпейді, тек оның тепе- теңдікке жетуін тездетеді;
*олар реакциялардың бағытын өзгертпейді
* фермент пен бейорганикалық катализаторлар реакция кезінде жұмсалмайды және өнімнің құрамына кірмейді.
*фермент пен бейорганикалық катализаторлар реакциялардың жүру жолындағы активтену энергиясының деңгейін төмендетеді
2.3. Ферменттер мен бейорганикалық катализатор-лардың айырмашылықтары:
Ферменттерге тән:
*арнайылық. Ферменттің (Е) биологиялық функциясы, құрамындағы активті орталықтың болуымен байланысты, ол .активті орталықпен белгілі бір қосылыс әрекеттеседі, ол қосылыс субстрат (S) деп аталады.
*каталитикалық белсенділік.Ферменттермен катализделетін көптеген реакциялар жоғары қуатты, олар катализденбейтін реакцияларға қарағанда 108 -1014 есе тез жүреді. Ферменттін әрбір молекуласы бір секунд ішінде 100-ден 1000-ға дейін субстрат молекуласын өнімге айналдыруға мүмкіндігі болады. Мысалы, каталаза ферментінің бір молекуласы бір секунд ішінде, қату температурасына жуық шамада, 50000 сутек пероксидінің молекуласын ыдырата алады : 2Н2О2 → 2Н2О+ О2
*конформациялық лабильдігі. Ферменттін биологиялық белсенділігі, кез-келген белок молекуласы сияқты, құрылысына тәуелді, соның ішінде активті орталықтың құрылысына. Жасуша ішінде ферменттің құрылысын біршама өзгертетін қосылыстар болады, олар бір байланыстарды үзу арқылы жаңа әлсіз байланыстарды түзеді; бұл ферменттердің белсенділігінің артуын да, төмендеуін де туғызуы мүмкін.
*фермент белсенділігі реттелуі мүмкін. Жасуша ішінде ферменттің әсері өте қатал реттелген; бір ферментативтік реакцияның өнімі басқа реакцияның субстраты болып табылады, осылай метаболиттік жолдар түзіледі. Әрбір метаболиттік жолда көптеген ферменттер ішінде негізгі немесе реттеуші ферменттер болады, олардың белсенділігі метаболиттік жолдың соңғы өнімге деген жасушаның қажеттілігіне байланысты өзгеріп отырады.
*ферментативті реакцияның өтуінің оптималды жағдайлары:көптеген тіңдерге тән температура 37-380С, қалыпты атмосфералық қысым, рН- 6,9-7,7. Ал бұдан химиялық катализдің айырмашылығы, олар қарқынды жүру үшін көптеген жағдайларда жоғарғы температура мен қысым және рН-тың экстремалды мәндері қажет болады.
2.4. Ферменттің активті орталығы : ӘСЕР ЕТУ АРНАЙЛЫҒЫ
2.4.1.Ферменттің активті орталығы (АО) - ол фермент молекуласындағы амин қышқылдары қалдықтары жиынтығының ерекше үшіншілік және төртіншілік құрылымдар арқылы кеңістікте орналасуы (2.1 сурет). Көбінесе активті орталықта келесі амнн қышқылдары кездеседі: серин, тирозин, аргинин, гистидин, лизин, цистеин,глутамин және аспарагин қышқылдары. АО-да субстратты және катализдік аймақтар болады. Субстратты аймақ- бұл ферменттің « қолдары». Ол ферменттің субстраттық арнайлығын қамтамасыз етеді, яғни амин қышқылдары қалдықтарының субстратпен комплементарлы байланысуын қамтамасыз етеді (байланысу бөлігі). Субстрат ферменттің әсеріне ұшырайтын зат. АО-ның екінші аймағы- каталитикалық аймақ. Ол ферменттің әсер ету ерекшелігіне себепші, яғни катализдейтін реакцияның түрін жеделдететуге жауапты аймақ,
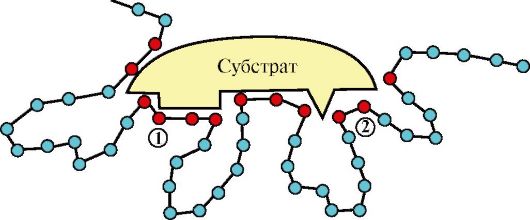
Сурет 2.1. Ферменттің активті орталығының құрылысы.
Қызыл түспен ферменттің активті орталығын құрайтын аминқышқылдары белгіленген: 1 – байланысу аймағы; 2 – каталитикалық аймақ
2.4.2.Арнайылық- ферменттің биологиялық маңыздылығын көрсететін ең қажетті қасиеттерінің біреуі.
2.4.3.Субстратты арнайлық- ферменттің белгілі бір немесе бірнеше субстратпен әрекеттесу мүмкіндігі.
Субстраттық арнайылықтың түрлері:
-абсолютті сустраттық арнайлық, егер ферменттің активті орталығы бір субстратқа ғана комплементарлы болса . Мысалы, аргиназа аргининге, сахараза сахарозаға, уреаза мочевинаға ғана әсер етеді.
Уреаза, мочевинаны көміртек диоксиді мен аммиакқа дейін гидролиздейді.
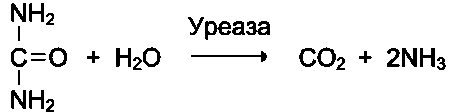
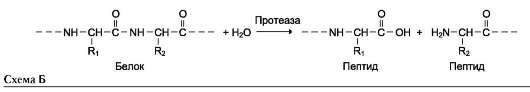
-салыстырмалы арнайылық (топтық субстратты арнайылық)-егер фермент байланыс түрі бірдей бір топ субстраттарға әсер етсе . Мысалы,мысалы альфа- амилаза гликозидтік байланысы бірдей крахмалмен гликогенге әсер етеді, протеаза (пепсин,трипсин,химотрипсин ) көптеген пептидтік байланысы бар белоктарға әсер етеді.
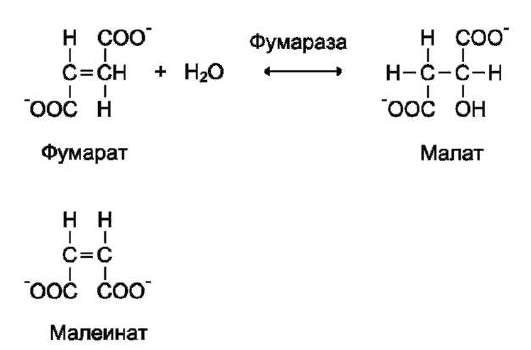
- стереохимиялық арнайылық - фермент субстраттың тек бір ғана стереоизомерлеріне абсолюттік арнайлық көрсетеді, мысалы, фумаратгидротаза (фумараза) фумаратқа ғана әсер етеді, ал малеин қышқылына (цис- изомер) әсер етпейді.
Субстраттық арнайлық АО-дағы субстраттық аймақтармен, ал екікомпонентты ферменттерде апоферменттерімен қамтамасыз етілген.
2.4. 4. Каталитикалық арнайылық ( әсер ету арнайлығы)- ферменттің белгілі бір реакция түрін катализдеуі. Ферменттер бір ғана субстратқа әсер етуі мүмкін , бірақ әрқайсысы оңымен тек белгілі бір реакцияны тездетеді. Бұл ферменттердің активті орталықтарының каталитикалық аймақтарының құрылысымен сәйкестігіне байланысты. Мысалы, адамның бауыр жасушаларындағы глюкоза-6- фосфат молекуласы әртүрлі төрт ферменттің субстраты болып келеді: фосфоглюкомутазаның, глюкозо-6-фосфатфосфа-тазаның, фосфоглюнизомеразаның және глюкозо-6- фосфатдегидрогена-заның. Бірақ аталған ферменттердің каталитикалық аймақтарының құрылыс ерекшеліктеріне қарай глюкозо-6-фосфаттан әртүрлі төрт өнім түзіледі ( сурет 2.2).
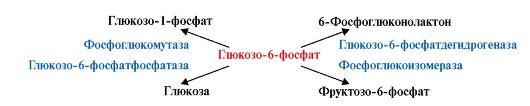
Сурет 2.2. Глюкозо-6-фосфаттың өзгеруінің каталитикалық жолдары.
2.4.5. Мультиферменттік комплексмысалында әсер ету арнайлықты тағы да көруге болады.
1.Мультиферменттік комплекс -бұл әртүрлі ферменттердің комплексі- бір субстратқа әсер етіп, оны жүйелі түрде және бір уақытта бірнеше реакциялар түрінде өзгерістерге ұшырататын ферменттер жүйесі. Мысалы, пируватдегидрогеназды мультиферменттік комплекс- митохондрияда пирожүзім қышқылының тотығудан декарбоксилденуін, келесі теңдеумен өрнектенетін көпсатылы күрделі процесті катализдейді:
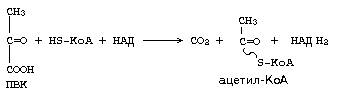 немесе
немесе
Пируват + НS-КоА + НАД+ → Ацетил- КоА+ СО2 + НАД•Н + Н+
Пируватдегидрогеназды жүйе молекулалық массасы 1·106 - 9·106құрылымдық бірлік, үш ферменттен тұрады: пируватдекарбоксилазадан (КФ 1.2.4.1); липоат-ацетилтрансферазадан (КФ 2.3.1.12); липоилдегидрогеназадан (КФ 1.6.4.3) ; және бес кофакторлардан: тиаминдифосфаттан (ТДФ), флавинадениндинуклеотидтен (ФАД), кофермент А-дан ( НS-КоА), никотинамидадениндинуклеотидтен (НАД+) және липой қышқылынан (СН2 –СН2 -СН - (СН2 )4 - СООН)
. | |
S - S
Реакция пирожүзім қышқылының (ПЖҚ) тотығудан декарбоксилденуі деп аталады.Пируватдегидрогеназды жүйенің әр ферменті көпсатылы процестің әртүрлі сатысын катализдейді: 1) пируватдекарбоксилаза (ПЖҚ-ның декарбоксилденуін арттырады, простетикалық топ - ТДФ); 2) липоатацетилтрансфераза (сірке қышқылының қалдығын НS-КоА кофермент молекуласына тасымалдайды, простетикалық топ- липой қышқылының амиді); 3) липоилпируватдегидрогеназа (ПЖҚ-ның дегидрленуін арттырады немесе оның тотығуын. Осы этаптың коферменті - ФАД , төмен тотығу-тотықсыздану потенциалымен,протондар мен электрондарды дигидролипоаттан НАД+-қа тасымалдайды –( аталған комплекстегі соңғы кофермент).
Осы реакцияның өнімі активті сірке қышқылы (АСҚ) - Ацетил- КоА .
Осылай мультиферменттік комплекс a-кетоглутараттың тотығудан декарбоксилденуін де іске асырады.
2.4.6.Сонымен бірге ферменттік ансамбльдердіажыратуға болады, жалпы олар да мультиферменттік комплекстерге жатады, бірақ құрастырылу прин-ципі біршама өзгеше. Осы комплекске кіретін ферменттер митохондрия мембранасында бекітіліп, белгілі ретпен орналасқан, бір биохимиялық процестің қатаң кезектілігінің шарттарын сақтайды, яғни олар бір- бірінен соң кезекпен әсер етеді, өйткені бір ферменттің субстраты алдыңғы ферменттің әсер еткендегі өнімі болып келеді. Оларға молекулаүстілік жүйелер жатады, олар өмірге маңызды функцияларды қамтамасыз ететін, мысалы тіңдік тыныс алу (тыныс алу ферменттерінің жүйесі арқылы электрондарды субстраттардан оттекке тасымалдау).
2.4.7.Ағзалықарнайылықты ферменттер (Изоферменттер)
Изоферменттер – бір субстратқа әсер етеді, бір типті реакциялардың жылдамдықтарын арттырады, бірақ әртүрлі ағзалар мен тіңдерде орналасады, ағзалық арнайылықтары болады, молекулалық массасы, заряд мөлшері және басқа да физика-химиялық қасиеттері бойынша ерекшелінеді, сондықтан оларды электрофорез кезінде бір-бірінен бөліп алуға болады. Ферменттердің ағзалықарнайылығы ауруға диагноз қоюда маңызды рөл атқарады, өйткені әртүрлі мүшелердің патологиясында қанға белгілі бір изофермент шығады ( 2.11.1.бөлімді қараңыз).
2.5.ФЕРМЕНТТЕРДІҢ ӘСЕР ЕТУ МЕХАНИЗМІ
| 2.5.1. Субстрат катализ кезінде ферменттің активті орталығымен байланыса отырып фермент-субстраттық (ES) комплексін түзеді, комплекс химиялық өзгеріске ұшырап өнім түзеді, ол өз кезегінде бөлініп шығады. Катализ процесін схема түрінде былай көрсетуге болады: |
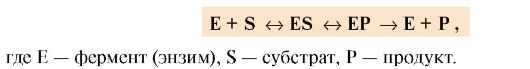
Ферментативті катализді сатыларға шартты түрде былай бөлуге болады (сурет 2.3).
1-сатыда ферменттің активті орталық аймағында субстраттың жақындауымен бейімделуі байқалады. II-сатыда индуцирленген сәйкестік нәтижесінде[Кошланд теориясы бойынша субстрат (S) пен ферменттің активті орталығы конформациясының өзгеруі] фермент-субстраттық комплекс (ES) түзіледі. III-сатыда субстраттағы байланыстар босаңсып, тұрақсыз комплекс фермент-өнім (ЕР) түзіледі. IV-сатыда комплекс (ЕР) ыдырап, активті орталықтан реакция өнімі және фермент бөлініп шығады. 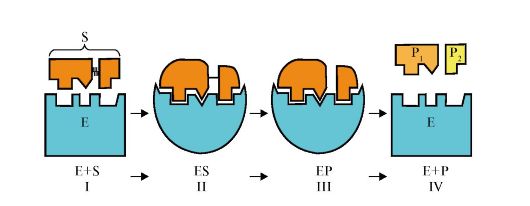
Сурет.2.3.Ферментативті катализ сатылары:
2.5.2.Ферменттердің кинетикалық теориясы 2 маңызды шарттарға негізделген:
1). Химиялық реакция молекулалар соқтығысқанда өтеді, яғни молекулалар байланыс түзуге мүмкіндік туғыза алатын ара қашықтақта болуы керек.
2). Соқтығысу нәтижелі болу үшін (реакция жүруіне әкелетін), әрекеттесетін молекулаларда энергетикалық кедергіні жеңетіндей жеткілік-ті энергия болуы қажет. Энергетикалық кедергі – бұл барлық молекулалар белсенді болу үшін жұмсалатын энергияның ең төменгі мөлшері. Активтендіру энергиясы (Еа, кДж/моль) - бұл бастапқы заттардың орташа энергиясына молекулалар арасындағы соқтығысу белсенді болу үшін қо-сымша берілетін энергия мөлшері (сурет. 2.4).
Фермент активтендіру энергиясын Еа төмендетеді ,яғни энергетикалық кедергінің биіктігін төмендетеді; нәтижесінде белсенді молекулалардың үлесі артады, реакция жылдамдығы да тездейді.
| уақыт |
| Соңғы өнім |
| Бастапқы субстраттар |
| Бос энергия |
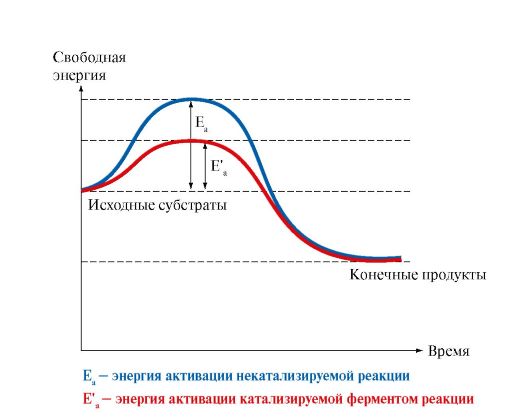
Сурет. 2.4. Еа - ферментсіз және Еа1- ферментпен катализденетін химиялық реакция барысында бос энергияның өзгеруі.
2.6. КОФАКТОРЛАР ЖӘНЕ КОФЕРМЕНТТЕР
Көптеген ферменттер белсенділік көрсету үшін табиғаты нәруыздық (белоктық) емес кейбір қосылыстарды - кофакторларды қажет етеді. Кофакторлардың екі тобы бар: металл иондары және коферменттер.
2.6.1.Металл иондары фермент қызметіне әртүрлі тәсілдер арқылы қатысады.
• Субстрат молекуласының құрылысын өзгертеді,бұл оның активті орталықпен сәйкестене әрекеттесуіне көмектеседі. Мысалы, субстрат рөлін комплекс Mg2+ -АТФ атқарады.
• Ферменттің активті орталығының нативті конформациясын қамтамасыз етеді.
Mg2+, Mn2+, Zn2+, Co2+, Mo2+ иондары ферменттердің активті орталықтарын тұрақтаңдыруға қатысады және оған коферменттің байланысуына көмектеседі.
• Ферменттің нәруыз молекуласының конформациясын тұрақтаңдырады.Мысалы, этанолдың тотығу реакциясын катализдейтін алкогольдегидрогеназа ферментінің төртіншілік құрылымын тұрақтаңдыру үшін мырыш иондары қажет.
• Ферментативті катализге тікелей қатысады.Zn2+, Fe2+, Мп2+, Cu2+ иондары электрофильды катализге қатысады. Ауыспалы валентті металл иондары электрондарды тасымалдауға қатысуы мүмкін. Мысалы, цитохромдарда (гемі бар нәруыздар) темір ионы бір электронды қосып және беруі мүмкін. Осы қасиеттерінің арқасында цитохромдар тотығу-тотықсыздану реакцияларына қатысады:

Сызбанұсқа түрінде фермент пен субстраттың әрекеттесуіндегі кофактордың рөлін комплекс E-S-Me ретінде көрсетуге болады, мұндағы Е - фермент, S - субстрат, Ме - металл ионы.
2.6.2. Коферменттер- органикалық қосылыстар, көбінесе витаминдердің туындылары, олар ферменттің активті орталығында орналасқан , сондықтан ферментативті катализге тікелей қатысады. Құрамында коферменті бар, ферментативті белсенділікке ие ферментхолоферментдеп аталады.Холофермент – бұл күрделі фермент.Ферменттің белоктық бөлігі апофер-ментдеп аталады,бұл бөлік коферментсіз каталитикалық белсенділікке ие бола алмайды.
Кофермент + Апофермент ↔ Холофермент
(белок)
активсіз активті
Кофермент ферменттің белоктық бөлігімен тек реакция кезінде байланысады немесе апоферментпен күшті ковалентті байланыстармен байланысады. Соңғы жағдайда простетикалық топдеп аталады.Көп таралған коферменттер мысалында- витаминдердің туындылары, сонымен қатар олардың ферментативті процестерге қатысуы –2.5 кестеде келтірілген.
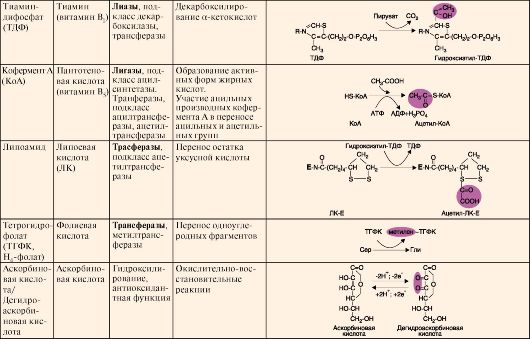
Кесте 2.5. Негізгі коферменттердің құрылысы мен атқаратын қызметтері
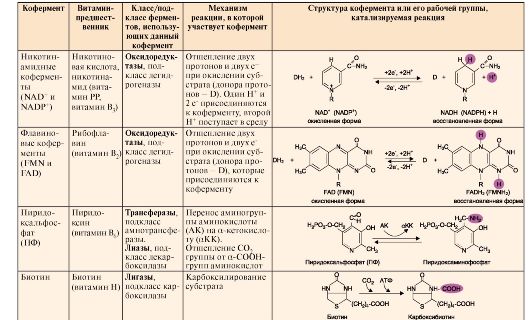
| Кофер-мент | Вита- мин- алғы зат | Берілген кофер-ментті пайдала- натын фермент-тің кла сы, тобы | Кофермент қатысатын реакция механизмі | Коферменттің құрылымы немесе жұмысшы тобы, катализдейтін реакция |
| Никотин-амидті ко-фермент- НАД+, НАДФ | Нико-тин Қыш-қылы,никотина-мид (РР-вита мині-В3) | Оксидо-редукта-залар, тобы –дегидро-геназалар | Субстраттан 2е- мен 2Н+ бөлініп субстрат тотығады, (Про-тон доноры-Д) 2е-мен Н+ ко- ферментке қосы-лады, 1Н+ерітін-діге ауысады | |
| Флавин-дік кофер-менттер ФМН ФАД | Рибофлавин( вита минВ2) | Оксидо-редукта-залар, тобы –дегидро-гена-залар | Субстраттан 2е- мен 2Н+ бөлініп субстрат тотығады, (Протон доноры-Д), олар коферментке қосылады | |
| Пиридоксальфосфат | Пиридок-син (В3) | Трансферазалар, тобы амино-трансферазалар Лиаза-лар,тобы декарбоксилаза-лар | Амин тобын α-кетоқыш-қылдарға, СО2 тобының α-аминқыш-қылдардан бөлінуі | |
| Биотин | Витамин-Н | Лигазалар,тобы карбок силаза лар | Субстратты карбоксилдеу | |
| Тиамин дифосфат | Тиа Мин (витаминВ2) | Лигаза, тобы ацилсинтетаза, Трасфе-раза, тобы ацил-трансфераза,ацетилтрансфераза | Май қышқыл-дарының ак-тивті форма-ларының түзілуі, ацетил және ацил топтарын тасымалдай-ды | |
| Кофер-мент А | Пантотен қышқылы(вит.В3) | Лигаза, тобы ацилсинтетаза, Трансфераза, то-бы аце-тил- және ацилтрансфераза | Сірке қышқы-лының қал-дығын актив-тендіреді, ацетил- және ацил топта-рын тасымал-дайды | |
| Липоа-мид | Ли-пой қышқы-лы | Трансфераза, то-бы аце-тилтрансфераза | Сірке қышқы-лының қал-дығын тасы-малдайды | |
| Тетраги дрофолат (Н5-фолат) | Фоль қышқы-лы | Трансфераза,то бы метил-трансфераза | Бір көміртекті фрагменттерді тасымалдайды | |
| Аскор-бин қышқы-лы(дегидроаскор-бин қышқы-лы | Ас-кор-бин қышқы-лы | Гидрок-силдеу, антиок-сидант-тық қызмет атқара-ды | Тотығу-тотықсыздану реакциялары |
2.7. ФЕРМЕНТТЕРДІҢ ЖІКТЕЛУІ МЕН НОМЕНКЛАТУРАСЫ
