B-глобулины
К этой фракции относятся некоторые белки системы свертывания крови и подавляющее большинство компонентов системы активации комплемента (от С2 до С7).
Основу фракции b-глобулинов составляют Липопротеины Низкой Плотности (ЛПНП) (Подробнее о липопротеинах: смотрите лекции “Метаболизм липидов»).
C-реактивный белок . Содержится в крови здоровых людей в очень низких концентрациях ,менее 10 мг/л. Его функция неизвестна. Концентрация С-реактивного белка значительно увеличивается при острых воспалительных заболеваниях. Поэтому С-реактивный белок называют белком "острой фазы" (к белкам острой фазы относятся также альфа-1-антитрипсин, гаптоглобин).
гамма-ГЛОБУЛИНЫ
В этой фракции содержатся в основном АНТИТЕЛА - белки, синтезируемые в лимфоидной ткани и в клетках РЭС, а также некоторые компоненты системы комплемента.
Функция антител - защита организма от чужеродных агентов (бактерии, вирусы, чужеродные белки), которые называются АНТИГЕНАМИ.
Главные классы антител в крови:
- иммуноглобулины G (IgG)
- иммуноглобулины M (IgM)
- иммуноглобулины A (IgA), к которым относятся IgD и IgE.
Только IgG и IgM способны активировать систему комплемента. С-реактивный белок также способен связывать и активировать С1-компонент комплемента, но эта активация непродуктивна и приводит к накоплению анафилотоксинов. Накопившиеся анафилотоксины вызывают аллергические реакции.
К группе гамма-глобулинов относится также криоглобулины. Это белки, которые способны выпадать в осадок при охлаждении сыворотки. У здоровых людей их в сыворотке нет. Они появляются у больных с ревматическим артритом, миеломной болезнью.
Среди криоглобулинов существует белок фибронектин. Это высокомолекулярный гликопротеин (молекулярная масса 220 кДа). Он присутствует в плазме крови и на поверхности многих клеток (макрофагов, эндотелиальных клеток, тромбоцитов, фибробластов). Функции фибронектина: 1. Обеспечивает взаимодействие клеток друг с другом; 2. Способствует адгезии тромбоцитов; 3. Предотвращает метастазирование опухолей. Плазменный фибронектин является опсонином - усиливает фагоцитоз. Играет важную роль в очищении крови от продуктов распада белков, например, распада коллагена. Вступая в связь с гепарином , участвует в регуляции процессов свертывания крови. В настоящее время этот белок широко изучается и используется для диагностики особенно при состояниях, сопровождающихся угнетением системы макрофагов (сепсис и др.)
Интерферон - это гликопротеин. Имеет молекулярную массу около 26 кДа. Обладает видовой специфичностью. Вырабатывается в клетках в ответ на внедрение в них вирусов. У здорового человека его концентрация в плазме мала. Но при вирусных заболеваниях его концентрация увеличивается.
Строение молекулы иммуноглобулина.
Молекулы всех классов иммуноглобулинов имеют сходное строение. Разберем их строение на примере молекулы IgG. Это сложные белки, которые являются гликопротеинами и обладают четвертичной структурой.
Схема строения молекулы иммуноглобулина представлена на рисунке:
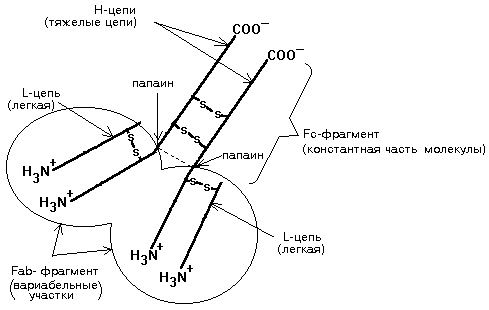
В состав белковой части иммуноглобулина входят всего 4 полипептидные цепи: 2 одинаковые легкие и 2 одинаковые тяжелые цепи. Молекулярная масса легкой цепи составляет 23 кДа, а тяжелой - от 53 до 75 кДа. С помощью дисульфидных (-S-S-) связей (мостиков) тяжелые цепи соединены между собой и легкие цепи также удерживаются около тяжелых цепей.
Если раствор иммуноглобулина обработать протеолитическим ферментом папаином, то молекула иммуноглобулина гидролизуется с образованием 2-х вариабельных участков и одной константной части.
Легкая цепь, начиная с N-конца, и такой же по длине участок Н-цепи формируют вариабельный участок - Fab-фрагмент. Аминокислотный состав Fab-фрагмента очень сильно различается у разных иммуноглобулинов. Fab - фрагмент может связываться с соответствующим антигеном слабыми типами связей. Именно этот участок обеспечивает специфичность связи иммуноглобулина со своим антигеном. В пределах молекулы иммуноглобулина выделяют также Fc-фрагмент - константная (одинаковая) для всех иммуноглобулинов часть молекулы. Формируется за счет Н-цепей . Есть участки, взаимодействующие с первым компонентом системы комплемента (или с рецепт орами на поверхности определенного типа клеток). Кроме того, Fc - фрагмент обеспечивает иногда прохождение иммуноглобулина через биологическую мембрану, например, через плаценту. Взаимодействие Fab-фрагмента со своим антигеном приводит к значительному изменению конформации всей молекулы иммуноглобулина. При этом становится доступным тот или иной участок в пределах Fc-фрагмента. Взаимодействие этого открывшегося центра с первым компонентом системы комплемента или с рецепторами клетки, что приводит к образованию иммунного комплекса "антиген-антитело".
Синтез иммуноглобулинов значительно отличается от синтеза других белков. Каждая из L-цепей кодируется группой из 3-х различных генов, а Н-цепь - четырьмя генами. Таким образом обеспечивается огромное разнообразие структуры антител, их специфичность к различным антигенам. В организме человека потенциально возможен синтез приблизительно 1 миллиона различных антител.
ФИБРИНОГЕН
Это белок, на который направлено действие системы свертывания крови. При свертывании крови фибриноген превращается в фибрин, который нерастворим в воде и выпадает в виде нитей. В этих нитях запутываются форменные элементы крови и, таким образом, формируется кровяной сгусток (тромб).
БЕЛКИ-ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ.
По функции белки-ферменты плазмы крови делят на:
а) Собственно ферменты плазмы - выполняют специфичные метаболические функции в плазме. К собственно ферментам плазмы относятся такие протеолитические системы, как система комплемента, система регуляции сосудистого тонуса и некоторые другие.
б) Ферменты, поступающие в плазму в результате повреждения того или иного органа, той или иной ткани в результате разрушения клеток. Обычно не выполняют в плазме метаболическую функцию. Однако для медицины представляет интерес определение активности некоторых из них в плазме крови в диагностических целях (трансаминазы, лактатдегидрогеназа, креатинфосфокиназа и др.)
ОРГАНИЧЕСКИЕ НЕБЕЛКОВЫЕ СОЕДИНЕНИЯ ПЛАЗМЫ
Делятся на две группы:
I группа - азотсодержащие небелковые компоненты
В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли "остаточный азот" (остается после осаждения белков):
- азот мочевины (50%)
- азот аминокислот (25%)
- низкомолекулярные пептиды
- креатин
- креатинин
- билирубин
- индикан
- некоторые другие азотсодержащие вещества
При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т.е наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов.
В понятие " остаточный азот" включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы). Подробнее о них - см. лекцию по теме “Протеолиз”.
II группа - безазотистые органические вещества
К безазотистым (не содержат азот) органическим веществам плазмы крови относятся:
1) Углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.).
2) Минеральные вещества крови (смотрите учебник Коровкина стр.449-452 и учебник Николаева стр.360, а также лекции по теме “Биохимия питания” - раздел ”Водно-минеральный обмен”.)
К Л Е Т К И К Р О В И И ОСОБЕННОСТИ ИХ МЕТАБОЛИЗМА.
ЭРИТРОЦИТЫ
Главная функция - транспорт газов: перенос О2 и СО2. Он возможен благодаря большому содержанию гемоглобина и высокой активности фермента карбоангидразы.
Зрелые эритроциты не имеют ядер, рибосом, митохондрий, лизосом. Поэтому обмен эритроцитов имеет ряд особенностей:
1. В зрелых эритроцитах не идут реакции биосинтеза белков.
2. Образование энергии - только путем гликолиза, субстрат - только глюкоза.
В эритроцитах существуют механизмы предохранения гемоглобина от окисления:
1. Активно протекает ГМФ-путь распада глюкозы, дающий НАДФ.H2
2. Высока концентрация глютатиона - пептида, содержащего SH-группы (подробнее: смотрите лекцию по теме “Биоокисление”).
ЛЕЙКОЦИТЫ
Клетки, выполняющие защитные функции - способны к фагоцитозу. В лейкоцитах много активных протеаз, расщепляющих чужеродные белки. В момент фагоцитоза увеличивается выработка перекиси водорода и увеличивается активность пероксидазы, что способствует окислению чужеродных частиц (антибактериальное действие). Лейкоциты богаты внутриклеточными низкоспецифичными протеиназами - катепсинами, локализованными в лизосомах. Катепсины способны к практически тотальному протеолизу белковых молекул. В лизосомах лейкоцитов в значительных количествах содержатся и другие ферменты: например, рибонуклеазы и фосфатазы.
