Определение изоферментного состава фумаратгидратазы в листьях кукурузы в условиях гипоксии
Регуляция экспрессии генов фумаратгидратазы в зеленых листьях кукурузы в условиях гипоксии
Бакалаврская работа
Направление 06.03.01 Биология
Профиль Биохимия
| Допущено к защите в ГЭК | ___.___.20___ |
| Зав. кафедрой | д-р биол. наук, проф., А. Т. Епринцев |
| Обучающийся | М.А. Зенищева |
| Руководитель | к.б.н., асс., Н.В. Селиванова |
Воронеж 2016
УДК 577.151.3
РЕФЕРАТ
Мария Алексеевна Зенищева
Тема: «Регуляция экспрессии генов фумаратгидратазы в зеленых листьях кукурузы в условиях гипоксии». Бакалаврская работа. ВГУ. Воронеж. 2016. 39 с. основного текста, 5 рис., 36 использованных источников.
ФУМАРАТГИДРАТАЗА, ГИПОКСИЯ, ОКСИД АЗОТА, ГЕН, ЭКСПРЕССИЯ, АКТИВНОСТЬ, РЕГУЛЯЦИЯ, ИЗОФЕРМЕНТ
Изучена динамика активности фумаразы в листьях кукурузы в условиях различного газового состава среды. Показано, что в условиях гипоксии наблюдается снижение данного показателя исследуемого фермента по сравнению нормальными условиями. Установлено, что в среде углекислого газа и азота наблюдается наличие двух форм фермента, митохондриальной и цитоплазматической. Установлен уровень экспрессии генов fum1 и fum2 в зеленых листьях кукурузы в контрольных и опытных образцах. Показана зависимость скорости экспрессии генов фумаразыв листьях кукурузы в различных условиях газовой среды.
Студент Зенищева М.А.
Руководитель Селиванова Н.В.
Оглавление
| Введение | |
| Глава I. ОБЗОР ЛИТЕРАТУРЫ | |
| 1.1.Гипоксия как стрессовый фактор | |
| 1.1.1 Дефицит кислорода как стрессовый фактор для растений | |
| 1.1.2 Энергетическое состояние клетки в условиях гипоксии | |
| 1.1.3 Функционирование митохондрий при недостатке кислорода | |
| 1.1.4 Влияние гипоксии на метаболизм растений | |
| 1.1.5 АФК при гипоксии | |
| 1.2 Фумаразная система | |
| 1.2.1 Общая характеристика фумаратгидротазы | |
| 1.2.2 Структура молекулы фумаратгидротазы | |
| 1.2.3 Генетическая детерминация | |
| 1.2.4 Двойная локализация фумаратгидротазы в клетке | |
| 1.2.5 Регуляция активности фумаратгидратазы | |
| Глава II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ | |
| 2.1. Цель и задачи исследования | |
| 2.2. Объекты и методы исследования | |
| 2.2.1 Объекты исследования | |
| 2.2.2 Создание экспериментальных условий с пониженным содержанием кислорода | |
| 2.2.3 Определение активности фумаратгидротазы | |
| 2.2.4 Электрофоретическое исследование изоферментного состава | |
| 2.2.5 Специфическое окрашивание фумаразы | |
| 2.2.6 Выделение суммарной клеточной популяции РНК | |
| 2.2.7 Аналитический электрофорез нуклеиновых кислот | |
| 2.2.8 Определение концентрации нуклеиновых кислот | |
| 2.2.9 Обратная транскрипция | |
| 2.2.10 Проведение полимеразной цепной реакции в реальном времени | |
| 2.2.11 Статистическая обработка данных | |
| Глава III Полученные результаты и их обсуждение | |
| 3.1.Динамика активности фумаратгидротазы в зеленых листья кукурузы в условиях гипоксии | |
| 3.2 Определение изоферментного состава фумаратгидратазы в листьях кукурузы в условиях гипоксии | |
| 3.3. Определение экспрессии гена fum1 и fum2 в листьях кукурузы в условиях гипоксии | |
| Заключение | |
| ВЫВОДЫ | |
| СПИСОК ИСТОЧНИКОВ ЛИТЕРАТУРЫ |
Список сокращений
АДФ – аденозиндифосфат
АТФ – аденозинтрифосфат
ДНК – дезоксирибонуклеиновая кислота
кДНК – комплиментарная ДНК
НАД+ – никотинамидадениндинуклеотид окисленный
НАДН – никотинамидадениндинуклеотид восстановленный
ОТ – обратная транскрипция
ПААГ – полиакриламидный гель
ПЦР – полимеразная цепная реакция
РНК - рибонуклеиновая кислота
ТАЕ – трис-ацеата-ЭДТА буфер
ФГ – фумаратгидратаза
ЦТК – цикл трикарбоновых кислот
ЭДТА – этилендиаминтетраацетат
Rf – электрофоретическая подвижность
ВВЕДЕНИЕ
В природе растения могут находиться в условиях пониженного содержания кислорода при переувлажнении или затоплении почв, при сильной загазованности в городах, произрастании в условиях высокогорья [5].
Виды растений различаются по восприимчивости к гипоксическому стрессу. Толерантность может варьироваться от нескольких часов до нескольких дней и даже недель в зависимости от вида, органов, испытывающих недостаток кислорода, этапа развития, а так же внешних условий, таких как температура.
В настоящее время механизмы растений, которые лежат в основе кратко- и долговременной устойчивости к анаэробным условиям исследуются многими учеными. Они направлены на предотвращение цитоплазматического ацидоза, адекватную реакцию на стресс, обеспечение минимальной энергией для поддержания жизнедеятельности, модификации экспрессии генов и изменении метаболических путей с целью акклиматизации к низкому содержанию кислорода в среде [34].
В условиях гипоксии электрон транспортная цепь митохондрий претерпевает некоторые изменения: растения осуществляют поиск других альтернативных соединений, способных выступать в качестве конечного акцептора электронов. Цикл Кребса так же не является исключением, соответственно и его компоненты тем или иным образом реагируют на недостаток кислорода.
Фумараза (фумаратгидратаза, КФ 4.2.1.2) - это фермент, который занимает одно из ключевых положений в регуляции дыхания митохондрий, а так же выполняет важную роль в обеспечении взаимодействия клеточных органелл. Данный фермент у некоторых организмов кодируется 2 генами fum 1 и fum2, в клетке представлен в цитозольной и митохондриальной форме. В роли митохондриального фермента он катализирует одну из стадий цикла: реакцию превращения фумарата в малат, а в цитозоле ему предписывают несколько функций: непосредственное участие в метаболизме азота и утилизация фумарата, образующегося в реакции, катализируемой аргининсукцинат-лиазой, находящейся в цитозоле или пластидах [31]. В связи с тем, что недостаток кислорода оказывает существенное влияние на обмен веществ в клетке, а фумаратгидротаза является важным участником метаболизма растений, целью нашей работы являлось изучить изменение активности фумаратгидротазы в зеленых листьях кукурузы в условиях гипоксии.
Глава I. ОБЗОР ЛИТЕРАТУРЫ
1.1.Гипоксия как стрессовый фактор
1.1.1 Дефицит кислорода как стрессовый фактор для растений
Растительный организм на различных этапах своего онтогенеза подвергается стрессовым воздействиям со стороны окружающей среды, таким как изменения температуры, интенсивности света, нехватки питательных веществ, избытку или недостатку воды. В дополнение к этим абиотическим стрессам, на растения также влияют различные инфекционные возбудители и насекомые-фитофаги [24].
Стрессовым фактором, рассматриваемым в данной работе, является гипоксия или дефицит кислорода. Растения демонстрируют удивительные способности переносить низкое содержание кислорода. Для того, чтобы переносить стресс, растения разработали многочисленные морфологические и физиологические адаптации, к которым относятся: удлинение междоузлия и листовые пластинки для эффективного поглощения газа. А так же обмен веществ, при котором ограничивается рост с целью сохранения углеводных и энергетических запасов до тех пор, пока кислород не будет снова в свободном доступе [22].
В природных условиях гипоксия может наблюдаться в случае избыточного увлажнения или затопления почв, в связи, с чем растение может длительное время испытывать недостаток кислорода. Так как его нехватка способна вызвать сильнейшие нарушения в метаболических процессах клетки, серьезной задачей для современных исследователей является изучение механизмов и поиск путей адаптации растений к условиям гипоксии [25].
1.1.2 Энергетическое состояние клетки в условиях гипоксии
Основным условием существования клетки является обеспеченность ее энергией. Условия гипоксии могут способствовать развитию энергетического кризиса, что приводит к серьезным нарушениям и повреждениям структур и функций клетки. Поскольку митохондрии являются основными органеллами для производства энергии, поддержание их в функциональном состоянии, является важной задачей во время кислородного голодания.
Для выполнения надлежащих функций митохондрии выработали особую стратегию, с помощью которой даже в условиях гипоксии они сохраняют работоспособность ЭТЦ без кислорода посредством использования нитрита в качестве терминального акцептора электронов. Производимый АТФ наряду с АТФ, генерируемым путем ферментации поддерживает процессы транскрипции и трансляции, необходимые для гипоксической выживания растений. Все это служит биохимической адаптацией, приводящей к стабилизации энергетического состояния и тем самым в защите растений в условиях гипоксического стресса [21].
1.1.3 Функционирование митохондрий при недостатке кислорода
Для работы ЭТЦ необходимым является наличие кислорода, любые изменения его концентрации могут оказывать влияние на создание энергетической валюты клетки. При гипоксии, цитохромокасидзы ограничены в способности использовать кислород, в то время как альтернативная оксидаза практически не функционирует в низко кислородных условиях из-за различных значений Кm этих двух терминальных оксидаз [23].
В своих исследованиях Мюллер и др. показали защитную роль нитратов для корневых митохондрий кукурузы и гороха. Было предположено, что нитрат (NO3) может выступать в качестве терминального акцептора электронов, который поддерживает работу электрон транспортной цепи в отсутствие кислорода [27]. Но нет никаких сообщений о том, что митохондрии содержат каких-либо транспортеров для нитратов. С другой стороны, нитраты могут косвенно поддерживать функциональность митохондрий при гипоксии, через его восстановлением до нитритов, которые могут быть импортированы в митохондриях, подобным переносчика найденному в хлоропластах или с помощью внутреннего митохондриального мембранного анион-канала (PIMAC), активируемого при низкой концентрации АТФ [28].
1.1.4 Влияние гипоксии на метаболизм растений
Концентрация кислорода в клетке влияет на метаболическую активность как животных так и растительных тканей, а также в клетках бактерий и дрожжах[14].В растениях даже небольшое снижение концентрации кислорода в окружающей среде приводит к изменению клеточной энергетики (соотношение АТФ и АДФ), увеличение NADH по отношению к NAD+ как правило, все это рассматривается как общий ответ на гипоксию аэробных организмов, в том числе и растений [11].
В исследованиях (Reena Narsai et.al 2011), в которых он с соавторами сравнивал реакцию риса и арабидопсиса на гипоксию путем оценивания уровня экспрессии генов, были получены следующие данные. В целом, изменения в экспрессии генов оказались весьма схожи между видами. Уровень экспрессии генов, кодирующих ферменты, участвующие в цикле трикарбоновых кислот (в том числе пируватдегидрогеназы), а также генов, кодирующих ферменты метаболизма аминокислот, как правило, снижался. Исключением из этого правила является экспрессия генов, кодирующих аланинаминотрансферазы, пируватдекарбоксилазы и лактатдегидрогеназы в Arabidopsis: транскрипт этих генов повышались при гипоксии [14].
В условиях, когда дыхательный метаболизм не может идти по привычному пути (через ЦТК и ЭТЦ) из-за нехватки терминального акцептора электронов, начинает работу фермент пируватдекорбоксилаза [12]. Важность ферментации этанола заключается в его большей эффективности, в молях, по отношению к лактат ферментации, для генерации NAD + и потреблением протонов. Кроме того, концентрации этанола обычно содержатся в растениях, являются недостаточными, чтобы вызвать токсический эффект. С другой стороны, этанол нелегко метаболизируется и, ввиду его растворимости в липидах двухслойной клеточных мембран, он может почти полностью диффундировать в окружающую среду, что приводит к потере углерода [19]. Лактат также образуются, но как упоминалось ранее, ферментация лактата менее эффективна.
Фермент пируватдекарбоксилаза являются частью набора «анаэробных белков», ферментов, синтезируемых во время гипоксии или аноксии. В дополнение к увеличению обилия белка, так же происходит посттрансляционное регулирование деятельности ПДК. Это происходит потому как изменяется значение цитоплазмотического pH c 7,5 в аэробных условиях на 6,8-7,2 в бескислородных. При рН ниже 7,2, активность ПДК достигает своего оптимума. Например, ПДК, извлеченный из колеоптиле риса, произрастающих в безкислородных условиях становится очень активным, как только рН падает ниже 7. После возвращения в аэробных условиях, цитоплазматические рН повышается обратно к нормальному уровню, активность данного фермента уменьшается, и углерод затем снова идет через пируватдегидрогеназы (ПДГ) в ЦТК, а не с помощью ПДК для ферментации в этанол [12].
Как говорилось ранее, экспрессия гена аланинаминотрансферазы в условиях гипоксии увеличивалось и как следствие происходило увеличение содержания аланина в клетке растения. Его накопление было объяснено следующим образом, во время затопления растительного организма пируват вступает в реакцию вместе с глутаматом с образованием аланина и 2-оксоглутарата, реакция катализируется ферментом аланинаминотрансферазы. В дальнейшем, 2-оксоглутарат используется в качестве субстрата ЦТК ферментом 2-оксоглутаратдегидрогеназой до образования сукцината с использованием в качестве ко-субстрата NAD+. Молекула NAD+ , для этой реакции, обеспечивается другим ферментом ЦТК малатдегидрогеназой, который в условиях гипоксии катализирует реакцию в обратном направлении, от оксалоацетата к малату. Впоследствии, малат может быть метаболизирован в либо до сукцината через фумаразу и сукцинатдегидрогеназу, как было показано на зеленой водоросли Selenastrum Minutum (Vanlerberghe и др., 1989) или в пируват через НАД-малеиновый фермент (Tronconi et al., 2008), Скорее всего, эти два пути действуют параллельно во время гипоксических условиях, хотя их индивидуальный вклад могут отличаться у разных видов и условий [14].
Сукцинат еще один метаболит, который выделяется при гипоксии. Было отмечено, что он накапливаться в всходах рассады и в клетках водорослей (Vanlerberghe и др, 1989; 1990;. Vanlerberghe & Turpin, 1990), подвергнутых дефециту O2, в результате частичной операции цикла трикарбоновых кислот, в обратном направлении. Это важная утечка метаболита, так как он может быть связан с потоком углерода в нормальном направлении для подачи оксоглутарата для азотистого обмена при дефиците O2. Предполагают, что янтарная кислота может придать устойчивость к гипоксии и аноксии, с помощью производства АТФ, хотя и в ограниченном количестве, внутри митохондрии и служит в качестве средства регулирования окислительно-восстановительного потенциала клетки. Кроме того, Menegus и др. (1989) предположил, что соотношения лактата и сукцината может быть принято в качестве критерия для классификации растений, по их толерантности к аноксии [19].
На основе проанализированных статей был сделан вывод о том, что в настоящее время достаточно исследований на тему влияния гипоксии на многие ферменты метаболических путей растений, однако такому важному ферменту ЦТК как фумаратгидротаза не было уделено внимания. В связи с этим, в своей работе мы оцениваем влияние гипоксии на данный фермент у растительных организмов.
1.1.5. АФК при гипоксии
В ответ на гипоксию растения начинают перестраивать метаболические пути таким образом, чтобы защитить и приспособить свой организм к новым условиям низкого содержания кислорода. И одну из ключевых ролей, определяющих стратегию организма при стрессе, играют активные формы кислорода [Gupta et al. 2012]. было показано, что при гипоксии в корнях происходит образование большого количества NO за счет работы нитратредуктазы, а так же электронного транспорта в митохондриях.
Несмотря на то, что исследования многих ученых были сфокусированы в основном на негативных последствиях образования АФК и их действия на клеточные структуры, при низкой концентрации кислорода, существует предположение о том, что именно АФК способствуют выходу из гипоксического состояния и осуществляют регуляцию при переходе к активному метаболизму в семенах и почках.
Возможно, АФК как сигнальные молекулы могут участвовать в инициации клеточных циклов при выходе из стрессового состояния, однако в настоящее время пока неизвестен механизм, способный четко регулировать образование данных молекул, препятствующий их чрезмерной генерации и как следствие гибели клетки. Тем не менее, механизм, способствующий выживанию растений при длительной нехватке кислорода во время затопления, должен быть идентифицирован и использован с целью повышения устойчивости к подобным стрессам [33].
1.2.Фумаразная система
1.2.1 Общая характеристика фумаратгидротазы
Фумаратагидротаза - ключевой фермент цикла трикарбоновых кислот, и хотя ЦТК открыт достаточно давно, тем не менее относительно мало известно, как этот важный путь может регулироваться в естественных условиях. Действительно даже фундаментальные вопросы, по поводу того, как этот цикл Кребса функционирует в освещаемых листьях, как на ферменты, входящие в его состав, действует избыток или недостаток тех или иных веществ, остаются спорными [15].
Фумараза является представителем лиаз и осуществляет обратимую реакцию превращения фумарата в L-малат [2]. Данный фермент в органическом мире представлен двумя основными классами: класс I встречается только у прокариот, а класс II имеет широкое распространение и обнаружен также у эукариот и архебактерий [35].
Более того класс II фумаратгидратазы это группа высококонсервативных последовательностей; митохондриальная форма фермента в цикле трикарбоновых кислот у эукариотических клеток тесным образом связана с а-протеобактериальными гомологами, являясь доказательством того, что гены были заимствованы у митохондриальных симбионтов. Более отдаленное отношение к классу II фумаразы имеют гены E.coli и Corynebacterium, кодирующие аспарат-аммоний-лиазную активность.
Оптимальными условиями функционирование фумаратгидротазы является значение pH 7,0-9,0 , при этом нет необходимости в ко-факторах , а сама каталитическая реакция зависит прежде всего от концентрации и природы присутствующих в среде анионов [29].
1.2.2 Структура молекулы фумаратгидротазы
Была определена полная аминокислотная последовательность фумаратгидротазы свиньи. Фермент представляет собой тетрамер,состоящий из идентичных субъединиц с молекулярной массой 48,5 кДа и который состоит из 466 аминокислотных остатков. Фумараза, выделенная из сердца свиньи на 96% идентична ФГ, находящейся в печени человека.. Прогнозирование вторичных структурных данного фермента показыло, что фермент содержит большое количество альфа-спирали с очень небольшим количеством бета-структур [30].
Raghavendra A.S. с соавторами 1994 в своей статье «Interdependence of photosynthesis and respiration in plant cells: interactions between chloroplasts and mitochondria» проводят анализ аминокислотных остатков сайтов связывания фумаразы в бактерии Е. coli. Авторами было обнаружено наличие пары связывающих сайта: сайт А включает в себя остатки аминокислот принадлежащие трем другим субъединицам. Остатки Трн-100, Сер-139, Сер-140, и Асн-141 из b-субъединицы, Трн-187, Гис- 188 из d-субъединицы, и Лиз-324, Асн-326 из с-субъединицы. Ученые помимо аминокислотных остатков, перечисленных выше, обнаружили молекулу воды, которая была связана с Сер-98, Трн-100, Асн-141 из b-субъединицы и Гис-188 из d-субъединицы. Второй сайт (сайт В), является как бы соседним и создан остатками, принадлежащими отдельной субъединице (b-субъединицы), то есть Ар-126, Гис-129, Асн-131, и Асп-132. Данные сайты участвуют в формировании водородных связей с субстратом и ингибиторами. Вопрос о том, какой же из пары сайтов является каталитическим сайтом фумаратгидротазы ,был решен путем эксперимента, основанного на сайт-направленном мутагенезе. Было показано, что мутации в сайте А приводит к потере удельной ферментативной активности, в то время как изменения в сайте В на активность фермента не оказывают существенного влияния [30].
В состав фумаратгидротазы входит 12 тиоловых групп, по 3 на каждую из четырех субъединиц. Причем тиоловые группы обладают меньшей реакционной способностью в активном ферменте, по сравнению с неактивной молекулой. Потому как в белке, подвергшемуся денатурации, количество тиоловых групп возрастает, то по их числу можно судить о потери активности фермента [16,17]
1.2.3 Генетическая детерминация
В Arabidopsis фумаратгидротаза кодируется двумя различными генами: FUM1 (At2g47510) и FUM2 (At5g50950). Два гена имеют одинаковую структуру экзонов и кодирует два белка, которые являются на 95% идентичны на уровне аминокислотной последовательности по всей длине, за исключением N-концевой области. Информация, закодированная в экзоне 1 в каждом гене отличается друг от друга так, что FUM1 и FUM2 кодируют концы 25 и 32 аминокислот (соответственно) с небольшим сходством, а последующие 23 остатков этого экзона идентичны. Это означает, что эти два гена возникли в результате дупликации с образованием измененного первого экзона [10]. Первый ген, FUM1, кодирует митохондриальных фермент, который является важным геном, а его удаление или нокдаун летально. Второй ген FUM2, обнаруженный в Arabidopsis, может кодировать цитозольную «эхоформу» [36]. FUM2 требуется для накопления фумарата в листьях, который, в свою очередь, необходимой для быстрого усвоения азота и роста при высоком содержании азота [10].
Фумаратгидротаза, которая содержится в клетках печени крысы, кодируется единственным геном, однако ее двойная локализация обуславливается наличием двух трансляционных продуктов. Генетический картирование показало, что крысиная фумараза имеет только одну, полноразмерную мРНК. Однако в исследованиях in vitro было обнаружено два трянсляционных продукта: первый полноразмерный предшественник, содержащий N-конец митохондриальной сигнальной последовательности; и второй, в виде короткой версии, которой не хватало сигнальной последовательности[29].
1.2.4 Двойная локализация фумаратгидротазы в клетке
Хорошо известно, что в эукариотических клетках молекулы одного белка могут быть расположены в более чем одном субклеточных компартменте, такое явление называется двойным нацеливание, бимодальным нацеливание или двойной локализацией [36]. Белки кодируются в ядре и посттрансляционно импортируются в соответствующие целевые органеллы, транспортные сигналы, как правило, селективными для одной определенной органеллы [32]. Если ранее считалось, что фумаратгидротаза – белок митохондрий, то сейчас, как показывают современные исследования, он так же локализуется в цитоплазме. В различных организмах его распределение осуществляется по-разному.
В митохондрии белковые молекулы могут попадать по средствам следующего механизма: белок синтезируются в виде предшественника, несущего N-концевую МТС последовательность. Предшествующие белки распознаются рецепторами внешней митохондриальной мембраны и транслоцируются через нее посредством транслоказного комплекса наружной мембраны (ТОМ). Предшественники затем перемещаются через внутреннюю мембрану через транслоказу внутренней мембраны (TIM).В естественных и искусственных условиях, большинство митохондриальных белков может быть успешно импортированы в митохондрии после прекращения трансляции[36].
В дрожжах S. Cerevisiae обнаружен другой механизм пострансляционного распределения белков между цитоплазмой и мотоходриями - механизма обратного переноса. Сначала белковые молекула направляются в митохондрии,где они обрабатываются митохондриальной пептидазой процессинга, однако часть белков движеться обратно в цитозоль Если в течение импорта, образующаяся аминокислотная цепь начинает скручиваться в митохондриальном матриксе, то по завершению импорта, она локализуется в митохондрии. А цепочка, начинающая процесс фолдинга в цитозоле, блокирует движение вперед, и выводится из механизма импорта, оставаясь при этом в цитоплазме [9].
1.2.5 Регуляция активности фумаратгидратазы
Главная задача фермента это функционирование, отвечающее требованиям организма. Фермент, чтобы осуществлять все присущие ему свойства с необходимой скоростью, должен обладать особыми механизмами, которые могут воспринимать и реагировать на сигналы, поступающие из окружающего мира [26].
Фумаратгидротаза – фермент, играющий важную роль в регуляции клеточного дыхания, а так же в обеспечение слаженного взаимодействия клеточных органойдов. Как и у всех ферментов, ее активность зависит от значения pH, цитозольная форма в Zea mays имеет низкий оптимум рН (6,5) и высокое сродство к малату (км 5 мкМ) по сравнению с митохондриальной формой (оптимум рН 7,0, км 50 мкМ) [18].
В качестве конкурентного ингибитора ФГ может выступать пиромеллитовая кислота, так как является структурным аналогом фермента, другим конкурентным ингибитором может быть 2-оксоглутарат. Кроме того было показано, для A. thaliana конкурентными ингибиторами фумаразы также являются AДФ, AMФ, цитрат, пируват и сукцинат.
Другим мощным ингибитором активности фумаразы является АТФ, однако существует следующая зависимость: в присутствии Mg2+ ингибирующее действие АТФ снижается. Ингибирование АТФ увеличивается при низких значениях рН, считается, что АТФH3- более эффективный ингибитор, чем АТФ4-. Более того, способность магния, снижать ингибирующее воздействие снижается при низких значениях рН, что связано с тем, что АТФH3- имеет более низкую аффинность, чем АТФ4- к Mg2+.
В качестве активирующих агентов фумарат гидротазы могут служить борат, арсенат, фосфат и ацетат, а так же SO42-, Cl- [20].
Глава II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Цель и задачи исследования
Целью данного исследования являлось изучение особенностей функционирования фумаратгидротазы в зеленых листьях кукурузы в условиях гипоксии.
В соответствии с целью работы, были выдвинуты следующие задачи:
1. Создание экспериментальных условий с пониженным содержанием кислорода;
2. Изучение динамики активности фумаратгидротазы в зеленых листьях кукурузы при выдерживании растений в течение 3ч, 6ч и 24 ч в условиях недостатка кислорода;
3. Выявление особенностей изоферментного состава фумаратгидротазы в зеленых листьях кукурузы в условиях гипоксии;
4. Определение уровня экспрессии генов fum1 и fum2 в листьях кукурузы при низкой концентрации кислорода.
2.2.Объект и методы исследования.
2.2.1.Объект исследования.
В качестве объекта исследования были выбраны 10-12-дневные растения кукурузы (Zea mays L.) сорта Воронежская 76 , выращиваемые методом гидропоники на водопроводной воде при постоянной температуре 25 С и 12-часовом световом дне.
2.2.2.Создание экспериментальных условий с пониженным содержанием кислорода
Растения в возрасте 10-12 дней перед постановкой опыта в течение суток выдерживали в темноте. Затем помещали в стаканчики с чистой водой и ставили на 24 часа в изолированные от поступления света вакуум-эксикаторы объемом 5 литров, через которые пропускались различные газовые среды – воздух, углекислый газ и азот из коммерческих баллонов.
Скорость поступления газа составила 17 см3/сек по разработанной ранее методике. По сертификату присутствие О2 в баллоне с азотом составляло не более 0,5 %, следовательно, используемые в опытах условия можно считать гипоксическими.
2.2.3.Определение активности фумаратгидротазы
Активность фумаратгидротазы определяли спектрофотометрическим методом на СФ 2000 при длине волны 240 нм. по увеличению оптической плотности в следствии образования двойной связи в молекуле фумарата.В качестве субстрата использовался малат натрия. [7]
Растительную навеску массой 150-200 мг растирали в ступке в соотношении 1:5 с 0,05М. фосфатным буфером pH 7.4, содержащим 5мМ ЭДТА и 5мМ MgSO4 смесь фильтровали и центрифугировали 5 мин , 5000 об/мин на ЦФ eppendorf Centrifuge 5804 R. Полученный супернатант использовали для определения активности фермента.
Среда спектрофотометрирования включала 0,05М фосфатный буфер рН 7,4 и 3мМ малат натрия. В кварцевую кювету вносили 3 мл. среды спекстрофотометрирования, вносили 10 мкл. пробы и определяли изменение оптической плотности при длине волны 240 нм. Активность фермента рассчитывали по формуле:
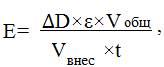
где ΔD – изменение оптической плотности при длине волны 240 нм, ε – коэффициент молярной экстинкции, Vобщ – общий объем ферментной вытяжки (мл), Vвнес – объем внесения (мл), t – время (мин).
Все процедуры по выделению фермента проводили при температуре 4оС.
2.2.4 Электрофоретическое исследование изоферментного состава
Фермент был выделен, как описывалось ранее в определении активности. Идентификация проводилась с использование метода диск-электрофреза в полиакриламидном геле с применением камеры для вертикального электрофореза производства Helicon VE-10. Концентрирующий гель представлен 4% полиакриламидным гелем, разделяющий 7% полиакриламидным гелем. В каждый карман геля вносилось количество пробы, соответвующее концентрации 3мг/мл. Для контроля движения фронта использовался 2мкл. 0,1% бромфенолового синего. В качестве электродного буфера применяли 0, 025М трис-HCl и 0,192М глицин рН 8,3.
Электрофорез ферментативных препаратов проводили в 2 этапа: при прохождение белковых проб через концентрирующий гель сила тока равнялась 19 мА, при прохождении проб через разделяющий гель сила тока увеличивалась на 6мА и составляла 25 мА. [7]
2.2.5 Специфическое окрашивание фумаразы
Специфическое окрашивание фумаратгидротазы проводилось с использованием 50мМ трис-HCl буфере рН 7,4, включающий 20мМ фумарат натрия, 3мМ NAD+, 1Е малатдегидрогеназы, нитросиний теразолий и FMS. Гелевая пластинка после окончания электрофореза извлекалась из камеры и помещалась в проявляющую смесь, где выдерживалась при температуре 37оС до появления белковых полос, после чего пластинка помещалась в 7% уксусную кислоту. Изображение геля с проявившимися полосами белка фиксировалось на фотокамеру. [7]
2.2.6 Выделение суммарной клеточной популяции РНК
При выделение РНК из зеленых листьев кукурузы использовался метод гуанидин-тиоционат-фенол-хлороформной экстракции [13]. Растительную навеску массой 150-200 мг растирали в буфере, содержащим гуанидин тиоционат и центрифугировали 5мин 3000об/мин. Затем отбирали надосадочную жидкость и приливали 1V смеси фенол-хлороформ-изоамиловый спирт в соотношении 25:24:1. После чего полученную смесь инкубировали на льду в течение 10 мин., а затем центрифугировали 5мин. 10000 об/мин., при температуре 4С. Далее использовалась надосадочная жидкость, к которой приливались 3V 96% этанола и 1 мкл ацетата натрия в качестве осадителя. Полученная смесь инкубировалась в течение 30 мин. при температуре -20оС. После инкубирования эппендорфы центрифугировали в течение 10 мин. 12000 об/мин., надосадок удалялся , а осадок высущивался до полного испарения спирта, нуклеиновые кислоты растворялись в 50мкл. стерильной воде.
2.2.7 Аналитический электрофорез нуклеиновых кислот
Аналитический электрофорез нуклеиновых кислот производился в 1% агарозном геле производства Helicon (Россия). В качестве буфера использовался 50´ ТАЕ-буфер, красителем для визуализации нуклеиновых кислот бромистый этидий. Гелевая пластинка помещалась в электрофоретическую камеру, заполненную 1хТАЕ буфером (рН 8,5).Пробы вносили в каждый карман в объеме 5 мкл. Электрофорез проходил в течение 40 мин. при напряжении 70В.
Оценка качества выделенных нуклеиновых кислот проводилась на трансиллюминаторе с длиной волны 312 нм. Результаты фиксировались системой фото-видео документирования DNA Analyzer (ДНК-технология, Россия) и обрабатывались с помощью программы Gel Explorer 1.0.
2.2.8 Определение концентрации нуклеиновых кислот
Концентрация нуклеиновых кислот в исследуемых пробах определялась с помощью программы http:// www.molbiol.edu.ru/protocol/10_01.html Измерения оптической плотности образцов проводились на СФ 2000 в кварцевых кюветах при длине волн 260 и 320 нм. Среда фотометрирования представляла собой 0,09% физиологический раствор, проба вносилась в количестве 5 мкл. Разница оптической плотности (D260/320) вносилась в программу, где автоматически производился расчет концентарции.
2.2.9 Обратная транскрипция
Обратная транскрипция осуществлялась при помощи набора MMLV Reverse Transcriptase. РНК матрица в количестве 1-6 мкл. (0,5-2мкг) с 1-3 мкл. олиго-dT праймера, позволяющего избирательно получить молекулы кДНК, соответствующие исключительно мРНК и объемом стерильной воды, необходимым до доведения общего объема смеси до 9 мкл., прогревались в течение 2 мин. при температуре 70оС, затем эппендорфы со смесью переносились на лед и к ним добавлялись 4 млк. 5´ буфера,4 мкл. 10мМ dNTP, 2 мкл DTT и общий объем доводился до 20 мкл. После чего полученную смесь прогревали при температуре 37С в течение 30 мин.
2.2.10 Проведение полимеразной цепной реакции в реальном времени
RT-ПЦР проводилось на приборе Bio-Rad DNA Engine Thermal Cycler Chromo 4 (Bio-Rad, США), краситель, применяемый в работе - SYBR Green. В качестве праймеров, подобранных с помощью программного обеспечения Primer3, использовали нуклеотидные последовательности:
к гену fum 1:
прямой – 5’ -gattacttcgatcattgaggt-3’
обратный 5’ -accagaactcgcggatgtggc-3’к гену fum 2: прямой – 5’-acaaacttgccattcgtcacc-3’;обратный – 5’-tggttcattctcaggcagaga-3’Параметры проводимой амплификации: денатурация 95оС – 5 мин., после чего цикл: 95оС – 30 сек., 60оС – 30 сек., 72оС – 30 сек. (детекция), финальная элонгация - 72оС – 10 мин. Количество кДНК контролировалось с использованием параллельной амплификации фактора элонгации ef-1α и разработанными нами ген-специфичными праймерами. Отрицательным контролем служила суммарная РНК не подвергшаяся обратной транскрипции.
Относительный уровень экспрессии исследуемых генов определялся при помощи 2-ΔΔCt-метода и программного обеспечения Opticon MonitorTM Software (Biorad, США).
2.2.11 Статистическая обработка данных
Каждый опыт проводился в 3-4 кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. На рисунках приводятся данные опытов, каждое значение есть среднее из трех измерений. Полученные данные обрабатывали с использованием статистических критериев. Обсуждаются статистически достоверные различия при р < 0,05 [4].
Глава III Полученные результаты и их обсуждения.
3.1.Динамика активности фумаратгидротазы в зеленых листья кукурузы в условиях гипоксии
Изучение механизмов приспособления организмов к изменяющимся условиям среды обитания становится особенно актуальным в связи с глобальными изменениями климата, загрязнением окружающей среды, а также для решения различных практических задач. Способность растений произрастать в обедненной кислородом среде связана с формированием целого комплекса анатомо-морфологических и физиолого-биохимических приспособлений, среди последних ведущая роль принадлежит приспособлениям процесса дыхания. Оптимальное для дыхания парциальное давление кислорода составляет 21%, снижение этого показателя отражается на уровне и структуре процесса дыхания. Качественные перестройки дыхания при недостатке кислорода представляют собой компенсаторные изменения в обмене веществ, выражающиеся в трансформации дыхательных путей, которые остаются недостаточно изученными, особенно для фотосинтезирующих органов растения [1].
В растениях кукурузы, помещенных в эксикатор с воздухом, активность фумаразы на протяжении всего эксперимента была наиболее стабильна. К 3 ч. экспозиции она составила 15,54 Е/гр.с.м. По прошествии 6 активность данного фермента установилась на значении 16, 13 Е/гр.с.м., а к окончанию опыты составляла 16,1 Е/гр.с.м. Данные результаты говорят о том, что в целом активность фумаратгидротазы в зеленых листьях кукурузы, изолированных от действия света, в условиях атмосферного воздуха не меняется.
С целью изучения действия стрессовых условий на активность фумаратгидратазы проводили исследования в различных газовых средах: среде азота и в среде углекислого газа. Контролем являлась атмосферный воздух. Результаты влияния гипоксии на функционирование фумаратгидротазы в листья кукурузы представлены на рисунке 1. Из графика видно, что в течение 24 часов эксперимента наблюдалось изменение активности исследуемого фермента.
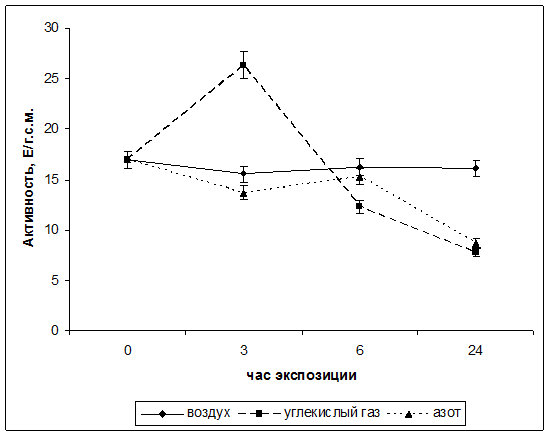
Рис. Динамика активности фумаратгидратазы в листьях кукурузы в условиях различной газовой среды.
Установлено, что максимальное значение активности ФГ наблюдается при экспозиции растений в течение 3ч в атмосфере углекислого газа и составляет 26,3 Е/г.с.м., однако к 6 часам экспозиции данный показатель резко снизился до значения в 12,28 Е/г.с.м. Через 24ч инкубации в среде CO2 достигалось наименьшее значение скорости функционирования фумаразы и составляло 7,75 Е/г.с.м. Такая динамика активности фермента может быть связана с тем, что повышенное относительно нормального значения содержание углекислого газа в атмосфере оказывает сильное влияние на все процессы жизнедеятельности растительного организма.
Компенсаторные перестройки дыхательного метаболизма при недостатке кислорода в значительной степени отражают использование сформированных систем гликолиза и пентозофосфатного пути окисления глюкозы, поставляющих АТФ, достаточно большое количество промежуточных веществ для биосинтезов и биологических восстановителей [8].
Углекислый газ в избытке может влиять на синтез белковых молекул, рост организма, активировать или угнетать те или иные физиологические процессы [12]. Отмечено, что повышение содержания CO2 в окружающей атмосфере способно снижать дыхание растения, а так же изменяет проницаемость мембраны клеток и как следствие снижать поглощение воды. [6]. Это может объяснить тот факт, что к концу эксперимента у растений, находившихся в условиях повышенного содержания углекислого газа, снижался тургор. В ряде исследований показано, что при гипоксии с избытком углекислого газа обмен углеводов, аминокислот и липидов усиливался, что являлось результатом специфического действия диоксида углерода на процессы обмена веществ у растительных организмов [3].
Резкое повышение активности исследуемого фермента в начале эксперимента может быть объяснено действием диоксида углерода как специфического стрессового фактора, способствующего мобилизации всех обменных процессов, однако при более длительном воздействии потенциал организма иссякает. По-видимому, активация дыхательного метаболизма в клетках листа компенсирует дефицит НАДФН, АТФ и продуктов обмена и одновременно при непродолжительной гипоксии вызывает усиление фотосинтетической активности и стабилизацию первичных фотохимических реакций, локализованных в хлоропластах.
Ранее показана активация работы ферментов разных дыхательных путей: гликолиза (ПК), спиртового брожения (АДГ), пентозофосфатного цикла (Г-6-ФДГ) и фотосинтеза (ГАФДГ – НАДФН) в проростках ячменя в условиях гипоксии как в темноте, так и на свету. Перестройки дыхательного метаболизма на анаэробный путь обмена в гетеротрофных и автотрофных тканях растения, кооперация процессов дыхания и фотосинтеза позволяют поддерживать энергетический баланс клетки, ведут к образованию необходимого количества восстановителей и промежуточных соединений, необходимых для различных биосинтезов, что обеспечивает наряду с другими защитными реакциями устойчивость растений к гипоксии [1].
В атмосфере азота наблюдался иной характер зависимости активности фумаразы от времени инкубации растений. В течение первых шести часов экспозиции активность исследуемого фермента изменялась незначительно. И составляла от 13,7 Е/г.с.м. до значения 15,3 Е/г.с.м. Однако, к 24ч эксперимента скорость функционирования фумаратгидротазы снизилась практически в двое и составила 8,67 Е/гр.с.м.. При этом, данное значение было выше, чем данный показатель в атмосфере углекислого газа.
Как известно, одним из возможных поставщиков АТФ является дыхательный метаболизм, неотъемлемая часть которого электрон транспортная цепь, для которой в аэробных условиях конечным акцептором электронов является кислород. В том случае, когда доступ к кислороду затруднен, синтез энергетических эквивалентов происходит преимущественно в реакциях спиртового и молочнокислого брожения, однако данная стратегия способна обеспечивать организм энергией весьма недолговременно. Но в настоящее время рассматривают другой механизм, помогающий выживать растениям в условиях гипоксии - это использование NO в качестве промежуточного акцептора электронов, способствующего окислению NADH, которое достигается в реакции образования NO и его последующее окисление обратно в нитраты [23].
Сукцинат важный метаболит, который выделяется при гипоксии. Было отмечено, что он накапливаться в всходах рассады и в клетках водорослей (Vanlerberghe и др, 1989; 1990;. Vanlerberghe & Turpin, 1990) , подвергнутых дефициту O2, в результате частичной операции цикла трикарбоновых кислот в обратном направлении.
Полученные нами данных согласуются с данной теорией, поскольку накопление сукцината может является следствием низкой активности сукцинатдегидрогеназы, окисляющей последний до фумаровой кислоты. При этом недостаток субстрата для фумаразы, проявляется в снижении ее активности по истечении 6 часов инкубации.
Определение изоферментного состава фумаратгидратазы в листьях кукурузы в условиях гипоксии
С целью выяснения механизма изменения активности фумаразы в течение 24 часов инкубации в бескислородной среде нами был исследован изоферментный состав фумаратгидротазы в листья кукурузы в условиях гипоксии методом электрофореза в полиакриламидном геле и последующим специфическим проявлением фермента. Анализ полученных нами данных позволил выявить наличие двух активных изоформ фермента в листьях кукурузы во всех экспериментальных условиях (рис 2). Эти данные подтверждают ранее установленное наличие двух функционально важных изоформ ФГ - митохондриальной и цитоплазматической [18].
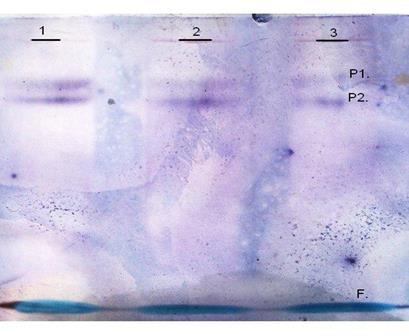
Рис. 2. Типичная электрофореграмма изоферментного состава фумаратгидратазы в листьях кукурузы. 1-атмосфера СО2, 2-атмосфера N2, 3-атмосфнера воздуха. Р1, Р2 – белковые полосы, F – фронт красителя бромфенолового синего
Данные электрофореграммы свидетельствуют, что в листьях кукурузы формы фумаратгидратазы имеют различную электрофоретическую подвижность. Предположительно, форма фумаразы с Rf=0,51 митохондриальная, а форма с Rf=0,41 цитоплазматическая. Наличие двух изоформ является условием нормального функционирования растительного организма. Так, форма, локализованная в митохондриях, является компонентом цикла Кребса и катализирует реакцию превращения фумарата в L-малат, то есть принимает участие в дыхательном метаболизме, в то время как цитоплазматическая выполняет целый ряд своих функций. Сообщается, что цитозольная форма фумаразы участвует в глюконеогенезе, поставляя малат в качестве субстрата, который метаболизируется в универсальное соединение пировиноградную килоту (ПВК), а также выполняет функцию по утилизации сукцината, поступающего из глиоксилатного цикла [18].
Поскольку специфическое проявление фумаразы в листьях кукурузы в условиях различной газовой среды показало однородность изоферментного состава, мы можем сделать вывод о том, что изменение активности фумаратгидротазы не связано с изменением количества изоформ.
