Визначення молекулярної маси білків
Молекулярна маса білків велика, і для їх визначення часто доводиться використовувати зовсім інші методи, ніж в органічній хімії.
Осмотичний тиск. Якщо речовина, розчинена у воді, відокремлена від чистої води мембраною, проникною для води і непроникною для цієї речовини, то вода поступатиме всередину об'єму, обмеженого мембраною, в якому знаходиться розчин. Причина цього лежить в необхідності компенсувати більш низьку концентрацію води усередині об'єму. В результаті цього рівноважному стану відповідатиме більш високий рівень рідини усередині об'єму в порівнянні з рівнем води, що знаходиться зовні. Обумовлений ним надмірний тиск рівний осмотичному тиску. Величина тиску визначається співвідношенням:
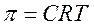
де p – осмотичний тиск в атмосферах; R – універсальна газова постійна; С – мольна концентрація розчиненої речовини; T – абсолютна температура.
Величину С можна замінити на 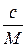 , де с – концентрація в грамах на літр, а M – молекулярна маса.
, де с – концентрація в грамах на літр, а M – молекулярна маса.
Тоді:
 , звідки:
, звідки: 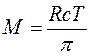
Схематичний дослід ставиться таким чином. Розчин білка в буфері заливають у мішечок, виготовлений з непроникної для білків мембрани і забезпечений трубкою, по якій може підійматися рідина. Ця трубка одночасно служить і манометром. Все це занурюють в посудину, куди налитий чистий буфер. Після досягнення рівноваги вимірюють висоту рідини в трубці і по ній обчислюють p. Цей метод придатний для не дуже великих білків, в протилежному випадку підйом рідини буде нікчемно малий. Важливо також, щоб в розчині знаходився білок тільки одного типу, інакше буде отримана цифра середньої молекулярної маси.
Аналітичне центрифугування. Центрифугування можна використовувати для фракціонування субклітинних частинок. З його допомогою можна також і осаджувати білки. Відцентрова сила прагне осадити білки на дно центрифужної пробірки, але завдяки дифузії молекули білка мають тенденцію мігрувати із зони високої концентрації в області більшого розбавлення. Застосовують два способи дослідження.
а) при відносно малій швидкості обертання після закінчення достатньо тривалого періоду часу відцентрова сила і дифузія приходять в рівновагу. Рівновага седиментації дозволяє визначити молекулярну масу білка при умові, якщо відомі параметри, які відносяться до його дифузійної здатності. Незручність цього методу в його тривалості. Арчібальд запропонував модифікацію, що дозволяє скоротити тривалість центрифугування до 1 – 2 годин.
б) при великій швидкості обертання відцентрова сила така велика, що сили дифузії виявляються в порівнянні з нею дуже малими. В цих умовах можна визначити швидкість седиментації білка. Утворюються величини в діапазоні від 1 до 200 одиниць Сведберга.
Дія відцентрової сили залежить не тільки від молекулярної маси білка, але також від форми його молекули і від зв'язків між білком і молекулами оточуючої його води.
Вимірювання такого роду проводять в аналітичних ультрацентрифугах, які служать стандартними приладами в цій області. Цей оптичний пристрій дозволяє стежити за переміщенням білка по пробірці в ході центрифугування. Осадження білка спостерігають як гауссову криву, що переміщується уздовж осі. Площа, між цією кривою і віссю абсцис, пропорційна концентрації білка. Гауссова крива утворюється в результаті відхилення світлового променя. Проходячи через розчин, промінь зустрічає на своєму шляху білок, коефіцієнт заломлення якого вище, ніж у розчинника.
Через певні проміжки час проводиться фотографування і таким чином обчислюється швидкість переміщення кривої, а отже, і швидкість седиментації білка. Результати цих вимірювань служать відправною точкою для визначення молекулярної маси.
Світлорозсіювання. Якщо освітлювати розчин солі дуже тонким пучком світла, то він проходить крізь розчин по прямій лінії. Якщо виконати те ж саме з розчином білка, то можна побачити, що частина світла розсіюється у всіх напрямках. Це явище обумовлено тим, що розміри білкових молекул співвимірні з довжиною хвилі світла і поводять себе як маленькі дзеркала, повернені у всі сторони, куди вони і розсіюють падаюче світло. Можна виміряти інтенсивність світла, яке розсіюється під різними кутами по відношенню до падаючого променя. Відношення інтенсивності світла, яке розсіяне під певним кутом (i), до інтенсивності падаючого світла (I) пропорційно концентрації білка (с) і його молекулярній масі (M), тобто:
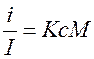
де К – константа, залежна від конструкції приладу.
Гель-фільтрація. Ми вже говорили про те, що хроматографія на декстрані дозволяє розділяти речовини за їх молекулярними масами. Хроматографічну колонку калібрують, використовуючи для цього ряд білків з відомою молекулярною масою, потім визначають молекулярну масу досліджуваного білка, шляхом зіставлення і екстраполяції. У такий спосіб знаходять приблизне значення молекулярної маси. Метод чутливий не тільки до молекулярної маси, але і до форми білкової молекули. Для білків однакової конфігурації об'єм рідини, яка елюює білок з колонки, обернено пропорційний логарифму його молекулярної маси.
Хімічні методи. Фізичні методи завжди дають наближені результати. Їх можна доповнити даними, отриманими за допомогою хімічних методів, які самі по собі також недостатні.
Наприклад, хочуть визначити молекулярну масу гемоглобіну. Аналіз показує, що цей білок містить 0,34% заліза. Якщо вважати, що на кожну молекулу гемоглобіну доводиться один атом заліза, то, виходячи з атомної маси заліза 56, можна знайти молекулярну масу білка із співвідношення:
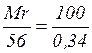 ,
, 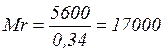
Фізичні методи дають для гемоглобіну величину молекулярної маси близько 65 000. Звідси можна визначити, що точна молекулярна маса гемоглобіну рівна 17000 ´ 4 = 68000 і, що кожна його молекула містить чотири атоми заліза.
Електронна мікроскопія. В даний час електронна мікроскопія дає збільшення в 20 Å, що дозволяє бачити білки. Підраховувавши число білкових глобул, можна отримати приблизну величину молекулярної маси. Для цього достатньо знати концентрацію білка в розчині і об'єм, який спостерігається в мікроскоп. Для того, щоб визначити цей об'єм, до розчину додають відоме число частинок латексу, які теж можна бачити в полі мікроскопа і порахувати.
Визначення молекулярної маси білкових субодиниць. В основному використовують два методи.
Електрофорез в поліакриламідному гелі з додецилсульфатом натрію (ДСН). Ми вже говорили, що при електрофорезі в поліакриламідному гелі швидкість пересування молекул білка залежить від їх заряду, форми і молекулярної маси. Якщо білок обробити денатуруючим детергентом ДСН, то, з одного боку, він денатурує і втрачає свою специфічну форму, а з іншою – розпадається на субодиниці, які приєднують ДСН і набувають однакового негативного заряду. Якщо ці субодиниці піддати електрофорезу в поліакриламідному гелі, то швидкість їх переміщення залежатиме тільки від молекулярної маси, причому вона виявляється обернено пропорційною логарифму молекулярної маси. Якщо білок складався з декількох субодиниць різної молекулярної маси, то виявиться декілька смуг.
Гель-фільтрація у присутності сечовини. Молекулярну масу субодиниць можна визначати і хроматографією на декстрані, якщо до проведення хроматографії додати до білка агент, який руйнує водневі зв'язки, наприклад сечовину високої концентрації.
Фракціонування білків
Дуже часто задачею біохімічного дослідження є вивчення білків тканин або біологічної рідини. Рішення такої задачі доводиться починати з відділення різних білків один від одного, тобто, з їх фракціонування. У ряді випадків необхідно отримати досліджуваний білок в чистому вигляді і перевірити ступінь його чистоти за допомогою спеціальних критеріїв. Якщо вихідним матеріалом служать клітини тканин, то першим етапом роботи є розтирання або гомогенізація, за якою слідує діаліз, що видаляє присутні в середовищі малі молекули. Після цього послідовно використовують різні методи фракціонування.
Висолювання. Високі концентрації сульфату амонія і фосфатів лужних металів осаджують білки. Поступово збільшуючи концентрацію солі, можна послідовно висолити всі розчинні білки. Прийом використовують як перший ступінь фракціонування. Його ефективність невисока – майже завжди в результаті одержують ще суміш білків.
Ізоелектричне осадження. Варіюють рН середовища. Поблизу ізоелектричної точки білки мають тенденцію до випадання в осад. Таким шляхом вдається розділяти білки, які дуже відрізняються один від одного за ізоелектричною точкою.
Адсорбційна хроматографія. Деякі тверді речовини у вигляді порошків або гелів володіють здатністю зв'язувати білки слабими і малоспецифічними зв'язками. До їх числа відносяться оксид алюмінію, фосфат кальцію (гідроксил-апатит), силікагель, крохмаль.
Десорбцію білків можна проводити з використанням найрізноманітніших елюентів. Якщо елюція є виборчою, то за допомогою колектора фракцій можна збирати білки роздільно один від одного, а іноді в очищеному вигляді.
Хроматографія на іонообмінних смолах. Це один з найефективніших методів. Смоли, які зазвичай використовують для фракціонування амінокислот, тут непридатні, оскільки полімери, з яких виготовлені смоли, мають дуже часту сітку і білки не можуть проникати через її осередки. Проблема була вирішена шляхом закріплення іонізованих груп на твердому носії – целюлозі. Таким чином отримали хроматографічний метод, в якому одночасно має місце як адсорбція, так і іонний обмін. Як аніонообмінник використовують діетиламіноетилцелюлозу (ДЕАЕ-целюлозу), а як катіонообмінник – карбоксиметилцелюлозу (Км-целюлоза).
Розчинені в буфері білки подають на колонку, а потім елююють буфером у якому постійно змінюється рН (зростає або убуває). При цьому білки розділяються відповідно до їх зарядів і значення pHi. Їх збирають за допомогою колектора фракцій.
Хроматографія на декстрані (гель-фільтрація) дозволяє фракціонувати білки за молекулярною масою.
Афінна хроматографія (хроматографія за спорідненістю). Якщо білок здатний специфічно утворювати комплекси з певною речовиною, то цю речовину „пришивають” ковалентними зв'язками до інертного порошку носія і заповнюють ним хроматографічну колонку. Коли через таку колонку пропускають білкову суміш, то на ній затримується тільки здатний до утворення комплексу білок, який потім можна зняти відповідним елюентом. Таким шляхом вдається виділити певний білок з складної суміші.
Кристалізація. Іноді з її допомогою вдається отримати білок в чистому вигляді. Цим методом готують високо очищені ферментативні білки. Дуже часто кристалізацію ведуть з концентрованих сольових розчинів.
Аналіз і критерії чистоти білків. Описані нижче методи дозволяють, з одного боку, ідентифікувати різні білки, які входять до складу біологічного препарату (аналіз). З другого боку, з їх допомогою вдається показати, що в результаті виділення був отриманий дійсно індивідуальний білок (критерій чистоти). Це часто більш тонкі методи, ніж ті, які використовуються для фракціонування, і вимагають значно менших кількостей білка.
Фізичні методи. Зональний електрофорез. Методом електрофореза на ацетаті целюлози або в поліакриламідному гелі вдається розділяти дуже схожі між собою білки. Якщо білок, що вноситься, чистий, то електрофорез дає одиночну тонку смужку.
Електрофокусування. Проводять зональний електрофорез, але при цьому використовують спеціальну суміш буферів, яка забезпечує плавну зміну рН уздовж всієї довжини гелю. В кінці електрофореза кожний білок опиняється в тій зоні гелю, де рН буфера співпадає із значенням ізоелектричної точки білка рНi.
Аналітичне центрифугування. Чистий білок повинен давати при ультрацентрифугуванні один симетричний пік.
Колоночна хроматографія. Індивідуальний білок у різних хроматографічних системах повинен виходити з колонки одним симетричним піком.
Імунологічні методи. Імунологічні методи дозволяють проводити аналіз білкової суміші, дають можливість довести ідентичність двох білків різного походження або перевірити чистоту білка. Найбільш широко використовують два підходи.
Метод подвійної дифузії (Уден-Оухтерлоні). Беруть чашку Петрі і заповнюють її агаровим гелем. Вирізують в гелі два круглі отвори і заповнюють один з них досліджуваним препаратом, а інший – сироваткою тварини, імунізованої цим препаратом. Білок, що міститься в досліджуваному препараті (антиген), одночасно з антитілом дифундують в агарі. В тому місці, де вони зустрічаються, утворюється білий осад. Якщо досліджуваний препарат містить не один, а два білки, то мабуть, що вони будуть дифундувати з різною швидкістю. В цьому випадку утворюються дві роздільні смужки осадів. Таким чином можна встановити, скільки білків міститься в препараті. Ця техніка дозволяє вирішувати і важливу задачу ідентифікації білків. Нехай необхідно з'ясувати, чи є у складі складного білкового препарату певний білок А. Готують сироватку, що містить антитіла як проти досліджуваного препарату, так і проти білка А, і заповнюють нею центральний отвір агарової пластинки. Вирізують ще два отвори – в один з них поміщають комплексний антиген, а в інший – білок А. Між отвором, що містить антитіла, і отвором комплексного антигена утворюється декілька смуг. Між отворами антитіл і білка А, природно, утворюється лише одна смуга. Якщо ця остання смуга зливається своїм кінцем з однією із смуг попереднього набору так, що як би служить її продовженням, то можна стверджувати, що білок А входить до складу суміші. Якщо ж лінії не з'єднуються або перетинають одна одну, то це вказує на відсутність білка А в суміші. Таким чином, цей метод може бути використаний як критерій чистоти білка, так і ідентичності двох білків.
Імуноелектрофорез (Грабар і Вільямс). Якщо антиген є складною сумішшю білків, наприклад сироватки крові людини, то число білків, а отже, і число смуг преципітації стає настільки великим, що картина на агаровій пластинці стає нерозбірливою. Тому необхідно заздалегідь за допомогою електрофореза розфракціонувати білки на склі від мікроскопа, який покритий шаром агару, пропускаючи через нього електричний струм. Під дією струму білки, захоплюються буфером і розподіляються по довжині скла по обидві сторони від центрально розташованого отвору. Антитіла вносять в подовжню канавку. Феномен подвійної дифузії виявляється, як і в попередньому методі, даючи серію дуг, кожна з яких відповідає одному з білків, які радіально дифундують від того місця, куди він був перенесений дією струму. Цей метод чудовий не тільки для аналізу, але і як критерій чистоти препарату.
Класифікація білків
Для класифікації білків часто використовують функціональний принцип, тобто їх класифікують виходячи з основних функцій, які вони виконують під час метаболізму. За цим принципом білки поділяють на такі групи: каталітично-активні, білки-гормони, білки-регулятори активності геному, захисні, токсичні, транспортні, мембранні, скоротливі, рецепторні, білки-інгібітори ферментів, білки вірусних оболонок, білки з іншими функціями. Хоча функціональна класифікація теж має деякі недоліки, зокрема при класифікації біфункціональних білків, проте вважають, що вона дає змогу глибше зрозуміти взаємозв’язок структури, властивості і функції молекул білка, закономірності їх еволюції та взаємодії з іншими речовинами.
Відомо понад 2000 білків тваринного, рослинного і мікробного походження. Їх класифікують переважно за фізико-хімічними властивостями та хімічним складом. За цими ознаками білки поділяють на дві групи – прості (протеїни) і складні (протеїди). Прості білки (протеїни) складаються тільки з залишків амінокислот; це лужні гістони та протаміни, рослинні нерозчинні проламіни та розчинні глутеліни, альбуміни та глобуліни, фібрилярні білки сполучної тканини (протеіноїди). Складні білки (протеїди) складаються з білкової (апобілок) та небілкової (простетична група, кофактор) частини. Це фосфопротеїди (містять залишок ортофосфорної кислоти), металопротеїди (містять іони металів), гемопротеїди (містять гем), хромопротеїди (містять вітаміни), глікопротеїди (містять вуглеводи), ліпопротеїди (містять ліпіди), нуклеопротеїди (містять нуклеїнові кислоти). Специфічні ділянки білка, що утворені унікальним розташуванням радикалів амінокислот, які необхідні для зв'язування та виконання специфічної функції зв'язування називаються доменами. Наприклад, у деяких ядерних білків містяться домени (з N- до С-кінця): мембранозв'язуючий, сполучний (шарнірний), регулятор-зв'язуючий, ДНК-зв'язуючий, для транспортуючого білка.
Залежно від фізико-хімічних властивостей, хімічного складу і значення розрізняють такі протеїни:
Альбуміни. Ці білки містяться в крові, лімфі, лікворі, насінні рослин, мікробах. До альбумінів належать лактальбумін, сироватковий альбумін, легумелін (гороху), лейкозин (пшениці). Альбуміни висолюються сульфатом амонію та іншими нейтральними солями лише при 80 – 100%-ному насиченні розчину. Молекулярна маса альбумінів коливається від 35 тис. до 70 тис. Добре розчиняються у воді і в розчинах солей. Виконують пластичні функції в тканинах і клітинах. До складу альбумінів входять лейцин (до 15%), лізин, аспарагінова і глутамінова кислоти, а також деяка кількість вуглеводів.
Глобуліни. За формою молекул глобуліни відносяться до глобулярних білків. Розрізняють сироваткові, молочні і яєчні глобуліни. До глобулінів належать міозин, тиреоглобулін, нейроглобулін, нейростромін, едестія конопель, гліцинін сої, фазеолін квасолі. На відміну від альбумінів глобуліни не розчиняються у воді, висолюються 30 – 50%-ним розчином сульфату амонію. Молекулярна маса глобулінів – від декількох тисяч до декількох мільйонів.
Важливе значення мають глобуліни плазми крові: a, b і g. g-Глобуліни є носіями імунітету, тому їх використовують для імунізації проти різних інфекційних захворювань. Кількісне співвідношення між альбумінами і глобулінами виражається альбуміно-глобуліновим коефіцієнтом (А/Г). У клінічно здорових він рівний 2, зменшується при деяких хворобах. До складу глобулінів входять амінокислоти: гліцин (3 – 4%), лейцин, валін, лізин, серин, глутамінова кислота, а також деяка частина вуглеводів.
Гістони відкриті А. Косселем у 1910 р. Мають молекулярну масу від 5 тис. до 37 тис. Гістони легко розчиняються у воді, при додаванні аміаку осаджуються, мають основні властивості, які обумовлені високим вмістом діаміномонокарбонових амінокислот (20 – 35%). До складу гістонів входять аргінін, лізин, гістидин. Багаті гістонами тканини залоз внутрішньої секреції (зобна), сперма риб, лейкоцити, еритроцити. За вмістом лізину і гістидину гістони розділяють на декілька фракцій. Гістони утворюють комплексні сполуки з ДНК – нуклеогістони. Приєднання і відщеплення гістона до молекули ДНК регулює біосинтез РНК і білка. Гістони забезпечують унікальну структуру ДНК, є складовою частиною гемоглобіну і багатьох складних білків.
Протаміни. Ці білки були відкриті Ф. Мішером і А. Косселем у складі нуклеопротеїдів сперми риб. Знайдені також у тканинах багатьох паренхіматозних органів (печінці, селезінці, нирках) і залозах внутрішньої секреції. Молекули протамінів побудовані в основному із залишків діаміномонокарбонових кислот, особливо багаті аргініном (до 70 – 87%). Мають основні властивості, утворюють солі з кислотами. При кип’ятінні не денатурують, легко розчиняються у воді. Амінокислотний склад протамінів, наприклад сальмін сьомги, наступний: 85% залишків аргініну, інше – серин, пролін, валін, гліцин, ізолейцин і аланін. В ядрах клітин протаміни асоціюють з ДНК. Виконують функції третьої спіралі ДНК, обмотуючи останню зовні. Малорозчинний комплекс протамінів з інсуліном використовується в медицині.
Проламіни. Всі проламіни – рослинні білки, цінні продукти харчування: гліадин пшениці і жита, гордеїн ячменю, зеїн кукурудзи, аверин вівса, оризин рису, каферин сорго. Вони погано розчиняються у воді, але добре в 60 – 80%-ному етанолі. Одержують проламіни екстракцією в 70%-ному етанолі з подальшою відгонкою спирту у вакуумі. Ці білки багаті проліном і глутаміновою кислотою. Так, молекула проламіна на 10 – 15% складається з проліна, на 20 – 50% з глутамінової кислоти, інші амінокислоти складають незначний відсоток. Проламіни бідні лізином. Їх молекулярна маса досягає 75 тис. Компонентний склад проламінів (наприклад, гліадина) генетично детермінований і визначає сорт рослини.
Глутеліни. Є важливими кормовими і харчовими білками. Містяться в зелених частинах рослин (до 43% складу білків) і зерні злаків. Розчиняються в розбавлених розчинах лугів і кислот. Молекули глутелінів багаті залишками глутамінової кислоти і лізину. Було виділено багато глутелінів: глутеліни пшениці і кукурудзи, оризенін рису. В зерні пшениці гліадин і глутенін утворюють клейковину, що визначає хлібопекарські якості зерна.
Протеїноїди (склеропротеїни). Протеїноїди, або опорні білки, поширені в організмі тварин. Молекулярна маса до 10 тис. Протеїноїди не розчиняються в холодній воді, розчинах лугів, кислот і солей, майже не розщеплюються протеолітичними ферментами, міцні і еластичні. В організмі виконують опорні функції. Речовини, близькі до протеїноїдів, були отримані в експериментах, які моделюють походження життя на Землі. До них належать:
Колаген – фібрилярний протеїноїд. Молекула колагену складається з трьох поліпептидних ланцюгів, закручених у спіраль. Колаген складає третину білків організму, є основним структурним компонентом сполучної тканини: сухожиль, зв'язок, хрящів, кісток, основи шкіри, луски риб. Молекули колагену мають ниткоподібну форму завдовжки – до 300 і завширшки до 1,5 нм. Для молекули колагену характерна повторюваність групи гліцин–проліл–оксипроліл. При тривалому кип’ятінні з водою колаген утворює желатину. Вона використовується для виготовлення столярного клею, в харчовій промисловості, в бактеріології (середовище), в хірургії (зупинка кровотеч) і т.д.
Кератин – фібрилярний білок. Кератин складає основу епідермісу, волосся, шерсті, пір’я, рогів, копит, луски. Розчиняється у воді, розчинах кислот, лугів, солей і в органічних розчинниках. При тривалому гідролізі з мінеральними кислотами розщеплюється до 7 – 14 різних амінокислот. Кератин багатий цистином, лейцином і глутаміновою кислотою. Має високу молекулярну масу (до 200 тис.). У складі молекули кератину виявлені скручена a-спіраль і розтягнута b-форма. Основною структурною одиницею a-спіралі є циліндрові мікроволокна, які складаються зі скручених попарно у вигляді спіралі протофібрил.
Еластин – опорний білок еластичних тканин. Складає білкову основу зв'язок, сухожиль, середньої оболонки великих артерій і вен. Еластин не розчиняється у воді навіть при кип’ятінні. В тонкій кишці частково розщеплюється ферментом еластазою. До складу молекули еластина входять гліцин, пролін, валін, лейцин та інші амінокислоти, окрім цистеїну, оксилізину, метіоніну і триптофану.
Фіброїн – білок шовкової нитки. Стійкий до гідролізу. Містить до 44% залишків гліцину, а також аланін і тирозин.
Протеїди розрізняють залежно від природи простетичної групи: нуклеопротеїди, хромопротеїди, фосфопротеїди, ліпопротеїди і глікопротеїди. Іноді до них відносять протеїдні комплекси.
Нуклеопротеїди. Складні білки, що складаються з простих білків і нуклеїнових кислот. Відкриті Ф. Мішером у 1868 р. у клітинах гною. Пізніше знайдені в різних клітинах людини, тварин, рослин, мікробів і вірусів. Білкова частина нуклеопротеїдів найчастіше складається з гістонів або протамінів. Залежно від природи нуклеїнової кислоти розрізняють два види нуклеопротеїдів – дезоксирибонуклеопротеїди (ДНП) і рибонуклеопротеїди (РНП).
Хромопротеїди. Складні білки, молекула яких складається з простого білка і забарвленої простетичної групи. Простий білок найчастіше представлений гістонами, простетичні групи – похідними ізоалоксазина (флавінові ферменти), каротину (родопсин) і порфірину (гемоглобін, міоглобін, геміновими ферментами – каталаза, пероксидаза, цитохромоксидаза, ін.).
Гемоглобін – червоний залізовмісний білок крові. Його молекула складається з білка глобіну і забарвленої речовини гема, яка містить комплексно зв'язане залізо. Хімічна будова встановлена M.В. Ненцьким у 1897 р. Г. Фішер у 1929 р. здійснив синтез похідного гема – гематина. Специфічність гемоглобіну для кожного виду тварин визначається хімічною будовою глобіну, оскільки гем для всіх хребетних однаковий. Кожний гем оточений одним з чотирьох поліпептидних ланцюгів глобіну. Молекула гемоглобіну складається з двох симетричних половинок. Кожна половинка має два ланцюги: a і b. a-Ланцюг містить 141 амінокислотний залишок b-ланцюг – 146. Таким чином, молекула гемоглобіну складається з 574 амінокислотних залишків. Гем зв'язаний з глобіном через гістидиновий залишок поліпептидного ланцюга. В зібраній у тетрамер молекулі всі чотири гема розміщені на поверхні і легко доступні для взаємодії з О2, CO2, СО. Субодиниці зв'язуються між собою сольовими, водневими і іншими зв'язками, які можуть легко розпадатися під впливом різних чинників на димери і частково на мономери.
Гемоглобін – головний структурний і хімічний компонент еритроцитів. Складає близько 94% сухої маси еритроцитів. В кожному еритроциті міститься близько 280 млн. молекул гемоглобіну.
Міоглобін. Молекула цього хромопротеїду утворена одним гемом і однією молекулою глобіну. Міститься в м'язовій тканині, де депонує кисень і передає його відповідним ферментним системам. Проявляє більшу спорідненість до кисню, ніж гемоглобін. У наземних тварин міоглобін зв'язує близько 10% всього кисню тканин (у людини – 14%), у морських тварин (дельфіна, тюленя, кита) – до 40%. У наземних тваринних міоглобін складає 2% сухої маси м'язів, у морських – до 20%. Структура молекули міоглобіну була вивчена Д. Кендрю у 1960 р. Молекула міоглобіну представлена довгим спіралевидним поліпептидним ланцюгом, що складається з 153 амінокислотних залишків, і гемом. Молекулярна маса – 17 тис. Міоглобін з газами утворює такі ж сполуки, як і гемоглобін (оксиміоглобін, карбоксиміоглобін, метміоглобін).
Фосфопротеїди. Молекули фосфопротеїдів при гідролізі розщеплюються до простих білків і ортофосфорної кислоти. Ортофосфорна кислота приєднується до молекули протеїну по місцю розміщення ОН-груп оксиамінокислот (серина і треонина). Це кислі білки за рахунок наявності у складі залишків ортофосфорної кислоти. Ортофосфорна кислота в молекулі фосфопротеїду утворює моно- і диефірні зв'язки, а в окремих випадках – пірофосфатні, які з’єднують поліпептидні ланцюги в білкову молекулу.
Казеїн – білок молока і молочних продуктів. Утворюється з казеїногена, від молекули якого при зсіданні відщеплюється пептид. Розчиняється в сольових розчинах, але не розчиняється у воді. При дії кислот випадає в осад. Молекулярна маса 24 – 400 тис. Складається з трьох фракцій – a, b і g. Молекула казеїну складається із залишків всіх незамінних амінокислот. Казеїн багатий лейцином, валіном, лізином, метіоніном і триптофаном. Найцінніша поживна речовина для новонароджених і дітей, джерело фосфору для утворення кісток, багатьох білків, фосфатидів, макроергів, коензимів. У промисловості використовується для добування пластмас, штучних волокон, багатьох фарб, клею.
Пепсин – основний фермент шлункового соку, найкраще діє в слабокислому середовищі. Розщеплює білки до пептидів. Був відкритий T. Шванном у 1836 р. і отриманий у вигляді кристалів Д. Нортропом у 1930 р. Молекулярна маса близько 34500. Молекула представлена поліпептидним ланцюгом, який складається з 340 амінокислотних залишків, трьох внутрішніх дисульфідних зв'язків і залишку фосфорної кислоти. Синтезується головними клітинами залоз дна шлунку у вигляді неактивного пепсиногену, після відщеплення від нього пептиду перетворюється на активний фермент.
До фосфопротеїдів відносяться білки курячого яйця, зокрема, овоальбумін – основа білка і білки жовтка, вітелін, вітеленін і фосфовітин.
Ліпопротеїди. Це складні білки, молекула яких складається з простого білка і ліпіду. Ліпопротеїди розчиняються у воді і мало (або зовсім) не розчиняються в органічних розчинниках. Ліпопротеїди – основа біологічних мембран і пластинчатих структур – мієлінових оболонок нервових волокон, хлоропластів та ін. Зустрічаються у вільному стані в лімфі, крові, молоці, яєчному жовтку. Синтез ліпопротеїдів забезпечує транспорт і розчинення ліпідів (та інших речовин) в тканинах і клітинах. Вітаміни А, D, E, К і F транспортуються в клітини у вигляді ліпопротеїдних комплексів з b-глобулінами плазми крові.
Детально вивчені a- і b-ліпопротеїди плазми крові. Перші з них складають близько 3% білків плазми крові. Їх молекула на 65% складається з протеїну і на 35% з ліпіду. b-Ліпопротеїди складають близько 5% білків плазми крові. Їх молекула містить близько 25% протеїну і 75% ліпіду. Молекулярна маса перших – близько 200 000, других – 1 300 000.
За швидкістю осідання при центрифугуванні ліпопротеїди ділять на чотири групи:
1) високої густини (містять 52% протеїну і 48% ліпідів, головним чином фосфатидів);
2) низької густини (21% білка і 79% ліпідів, в основному холестерину);
3) дуже низької густини (9% білка і 91% ліпідів, в основному тригліцеридів);
4) хіломікрони (1% білка і 99% жирів).
У молекулах ліпопротеїдів білкова частина з'єднується з ліпідом завдяки різним видам хімічного зв'язку (особливо іонного). Розчиненню ліпопротеїдів у тканинних рідинах і клітині сприяє структура їх молекули, оскільки білкова частина молекули з гідрофільними групами знаходиться зовні, а гідрофобні ділянки розміщуються всередині. Іноді ліпідна частина зосереджена у вигинах поліпептидного ланцюга, що сприяє розчинності білка.
Глікопротеїди.Молекули глікопротеїдів при гідролізі розщеплюються на простий білок і вуглеводну простетичну групу, яка зазвичай складається з гіалуронової і хондроітинсірчаної кислот, гепарина, деяких глікополісахаридів. При гідролізі простетичної групи утворюються гексози (маноза, галактоза, глюкоза), гексозаміни (глюкозамін, галактозамін) і кислоти (глюкуронова, оцтова, сірчана). Молекулярна маса білків різна – від декількох десятків тисяч до мільйонів. Білки містяться у всіх тканинах тварин і рослин, в мікробах і вірусах. Вміст вуглеводної частини в глікопротеїді варіює від декількох часток відсотка до 80%. Зв'язок у молекулі глікопротеїду між білковою частиною і простетичною групою міцний і розривається тільки після тривалого кислотного або ферментативного гідролізу. Він зазвичай формується за рахунок взаємодії вуглеводного компоненту з СООН-групою залишку аспарагінової кислоти. Найбільш поширені в організмах муцини і мукоїди.
Муцини – слизові виділення епітеліальних покривів слизових оболонок харчового каналу, дихальних і сечостатевих шляхів, слинних залоз. Виконують захисну функцію, оберігаючи оболонки від механічних і хімічних пошкоджень. Стійкі до гідролізу.
Мукоїди – глікопротеїди хрящової (хондромукоїди) і кісткової (остеомукоїди) тканин, яєчного білка (овомукоїд), синовії, склоподібного тіла ока, зв'язок і сухожиль і т.д. Значення їх різноманітне і визначається функцією органу і тканини.
До глікопротеїдів відносяться деякі гормони передньої частини гіпофіза – тиреотропін і фолікулостимулюючий, речовини які визначають групу крові, імуноглобуліни, деякі білки крові і тканин (протромбін), ферменти та ін.
