Дизайн исследования и пациенты
Введение многофазного пробиотического продукта женщинам в перинатальном периоде по-разному влияет на профиль цитокинов грудного молока и может иметь полезные эффекты на неонатальные функциональные симптомы желудочно-кишечного тракта. Рандомизированное клиническое испытание
Мария Элизабетта Бальдассарр , 1, * Антонио Ди Мауро , 1 Паола Мастрорарино , 2 Маргерита Фанелли , 3Доменико Мартинелли , 1 Флавия Урбано , 1 Даниэла Капобианко , 2 и Никола Лафоргия 1
Информация об авторе ► Примечания к материалам ► Информация об авторских правах и лицензии ►
Эта статья была приведена в других статьях в PMC.
Идти к:
Абстрактные
Справочная информация. Пробиотические добавки к женщинам во время беременности и лактации могут модулировать состав грудного молока, при этом иммунные преимущества передаются их младенцам. Цель: Цель исследования заключалась в оценке влияния высокодозовых пробиотических добавок на женщин во время поздней беременности и лактации на профиль цитокинов и секреторного IgA (sIgA) в грудном молоке и, таким образом, для изучения того, могут ли различия в составе грудного молока влиять на лактоферрин и уровни sIgA в образцах стула новорожденных. Была также оценена безопасность применения пробиотиков для материнства на фоне роста новорожденных и желудочно-кишечных симптомов. Методы. В двойном слепом плацебо-контролируемом рандомизированном исследовании 66 женщин принимали либо пробиотик ( n = 33), либо плацебо ( n= 33) ежедневно. Уровни интерлейкинов (IL-6, IL-10 и IL-1β), трансформирующие фактор роста-β1 (TGF-β1) и sIgA в грудном молоке; и уровень sIgA и лактоферрина в образцах новорожденных стула анализировали при рождении, а затем снова на один месяц жизни. Также проводилась антропометрическая оценка и анализ желудочно-кишечных осложнений у новорожденных. Результаты. Пробиотическое потребление матери оказало значительное влияние на средние значения IL6 в молозиве и на значения IL10 и TGF-β1 в зрелом грудном молоке. Значения Fecal sIgA были выше у новорожденных, чьи матери взяли пробиотический продукт, чем в контрольной группе. Пробиотическая добавка к матерям, по-видимому, снижает заболеваемость инфантильными коликами и регургитацией у младенцев. Вывод:
Ключевые слова:педиатрическая гастроэнтерология, пробиотики / пребиотики, иммунология, функциональные заболевания ГИ
Идти к:
Введение
В нескольких работах показано, что пробиотические добавки к женщинам во время беременности и лактации могут модулировать микробную молочную композицию и уровень разного иммунитета грудного молока и модулирующих иммунитет молекул, при этом выгоды для здоровья варьируются от желудочно-кишечных симптомов до аллергии, передаваемых детям [ 1 ] ,
Наши ранее опубликованные исследования показали, что один и тот же высококонцентрированный пробиотик с множественной деформацией, дополненный матерями в перинатальном периоде, был связан с модуляцией вагинальной микробиоты и секреции вагинальных цитокинов [ 2 ] и с увеличением уровней бифидобактерий грудного молока и лактобациллы у женщин с вагинальными родами, независимо от концентрации молока в функциональных компонентах, таких как олигосахариды и лактоферрин [ 3 ].
Улучшенная микробная молочная композиция может иметь важные последствия для здоровья новорожденного [ 4 ]. Однако мы не обнаружили никакой корреляции между количеством бифидобактерий и лактобацилл в материнском грудном молоке и уровнями в фекалиях младенцев [ 5 ].
Мы предположили, что цитокины и другие иммунорегуляторные факторы, модулированные пробиотическими добавками, могут сыграть ключевую роль в создании микробиоты человеческого молока.
Первичные результаты этого исследования состояли в том, чтобы оценить, могут ли дополнения материнской пробиотики модулировать профиль цитокинов и секреторный IgA (sIgA) в грудном молоке и, таким образом, изучать, могут ли различия в составе грудного молока влиять на уровни лактоферрина и sIgA в образцах новорожденных кала.
Наш вторичный результат состоял в оценке безопасности высококонцентрированного введения пробиотиков у матерей для новорожденных, оценки роста и появления наиболее частых желудочно-кишечных симптомов у младенцев. Высказывалось предположение, что перинатальная манипуляция микробиотой кишечника с помощью пробиотиков может привести к снижению функциональных симптомов желудочно-кишечного тракта [ 6 ].
Предыдущее исследование показало, что раннее введение пробиотика в раннем возрасте может предотвратить появление функциональных симптомов желудочно-кишечного тракта у новорожденных [ 7 ]. Правильный механизм действия пробиотиков в этой области до сих пор не выяснен, но он, по-видимому, опосредуется активностью на синдром внутренних чувствительных нейронах с улучшением подвижности кишечника, а также положительным эффектом на функцию и висцеральную боль [ 8 ] , В последнее время исследование на крысах позволило выявить новые регуляторные механизмы и специфические закономерности гениальной экспрессии, вызванные воздействием одного и того же высокопрочного пробиотика с высокой концентрацией, который может иметь клинические показания при висцеральной боли [ 9]. Кроме того, важно отметить, что преимущества для здоровья, предоставляемые бактериями пробиотиков, специфичны для штаммов.
Идти к:
Экспериментальная секция
Анализ грудного молока
Чтобы оценить, модулирует ли пробиотические добавки для материнства профиль цитокинов и sIgA в материнском молоке, два образца материнского молока были собраны путем ручной экстракции: молозиво в течение 72 часов после родов (T0) и зрелого молока через 30 дней после родов (T30).
Уровни интерлейкинов (IL-6, IL-10 и IL-1β) и трансформирующий фактор роста-β1 (TGF-β1) анализировали с использованием коммерческих наборов иммуноферментного анализа (ELISA) (CLB Pelikine Compact, Research Diagnostics Inc., Flandern, NJ, USA и R & D Systems Inc., Миннеаполис, Миннесота, США, соответственно) в соответствии с рекомендациями производителя. Все образцы были проанализированы в двух экземплярах. Значения выражены в мкг / мл. Уровни IgA определяли с помощью нефелометрии (анализатор нифелометра Беринга, Dade-Behring, Марбург, Германия).
Оценка безопасности
Для оценки безопасности материнских пробиотических добавок на моделях роста новорожденных антропометрические данные (вес и рост) были собраны при T0 и T30. Модели роста оценивались с помощью анализа индекса массы тела. Неспособность процветать рассматривалась, когда вес младенца составлял менее 80% идеального веса для его возраста [ 10 ].
Согласно протоколу исследования, структурированный дневник о желудочно-кишечных событиях у новорожденных, такой как количество минут безутешного плача в день (инфантильная колика, как уже описано в литературе [ 11 ]), количество эпизодов регургитации в день, количество движений кишечника в день день и консистенция стула, в соответствии с шкалой формы бристольского табурета для детей, были предоставлены родителям [ 12 ].
Мы идентифицировали детскую регургитацию и детскую колику после критериев Рима III в период неонатального / детского возраста [ 13 ]. Мы определили колики у младенцев, как здоровые младенцы, у которых наблюдались приступы раздражительности, суеты или плача, которые начинались и прекращались без очевидной причины в эпизодах, длившихся три или более часов в день и возникающих не менее трех дней в неделю в течение как минимум трех недель во время период обучения. Мы определили детей с функциональной регургитацией как младенцев, которые извергались два или более раз в день в течение трех или более недель в течение периода исследования, в отсутствие рвоты, гематемизации, аспирации, апноэ, неспособности к процветанию, аномального позерства или у которых были проблемы с кормлением или глотанием в течение этого времени.
Статистический анализ
Размер выборки был рассчитан с использованием статистического программного пакета статистических программ статистического анализа 9.3 (SAS Institute, Cary, NC, USA), основанного на эффекте введения пробиотического продукта на уровень TGF-β1 грудного молока [ 14 ]. Уровень значимости был установлен на 5% (двухсторонний) и мощность до 80%. Мы подсчитали, что для определения разницы уровня TGF-β грудного молока между лечением и группой плацебо требуется минимальный размер выборки 54 матерей. Количественные данные матери и новорожденных были выражены как среднее, SD и диапазон. Тест t для непарных образцов использовался для сравнения групп вмешательства.
Тест Чи-квадрат и точный критерий Фишера были использованы для сравнения качественных аспектов в двух группах.
Для оценки влияния времени, эффекта лечения и влияния взаимодействия на профиль цитокинов и значений sIgA в грудном молоке, а также на значения фекальных лактоферрина и sIgA проводили двухстороннюю повторную меру ANOVA.
Когда данные обычно не распределялись по Шапиро-Уилксу, выполнялось логарифмическое преобразование.
Тест Хи-квадрат и относительный риск (RR) были рассчитаны для оценки возможной связи между пробиотическим добавлением и функциональным расстройством желудочно-кишечного расстройства (FGID).
Логистическая регрессия была выполнена для оценки того, какие факторы (пробиотики, тип доставки или материнское молоко / молоко-бутылочное молоко) оказали наибольшее влияние на начало ФГИГ.
Идти к:
Результаты
На рисунке 1 показана блок-схема процесса прохождения фазы параллельного рандомизированного исследования двух групп .
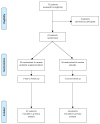
Рисунок 1
Схема исследования.
Из 72 пар матери / новорожденного, оцененных на предмет приемлемости, 67 были зарегистрированы и рандомизированы для получения пробиотиков (T: пробиотик, n = 33) или плацебо (C: плацебо, n = 34).
После одного месяца вмешательства 1 пара была потеряна для наблюдения, и 66 пар завершили исследование и были введены в анализ результатов.
Характеристики матерей и новорожденных на исходном уровне приведены в таблице 1 .
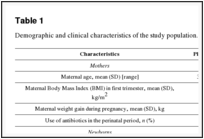
Таблица 1
Демографические и клинические характеристики исследуемой популяции.
Никаких существенных различий в отношении материнского возраста, индекса массы тела (ИМТ) в первом триместре, увеличения веса во время беременности, использования антибиотиков в перинатальных периодах или новорожденных (гестационный возраст, вес при рождении, пол, тип доставки и тип питания) были наблюдаемые между двумя группами на исходном уровне, что свидетельствует о успешной процедуре рандомизации.
Никаких обнаруживаемых побочных эффектов не наблюдалось у матерей или новорожденных.
Первичные результаты при наблюдении Т30 показаны на рисунке 2 , рисунке 3 и рисунке 4 .
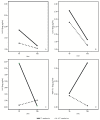
фигура 2
Модели цитокинов грудного молока при лечении (T) и контроле (C) новорожденных в моменты наблюдения T0 и T30. ( A ) (средние значения интерлейкина-1β); ( B ) (средние значения Inteleukin-10); ( C ) (средние значения интерлейкина-6); ( D ) (Трансформирующий фактор роста означает ...
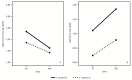
Рисунок 3
Секреторный IgA (sIgA) в грудном молоке и стуле, в группах лечения (T) и контроля (C) в моменты наблюдения T0 и T30. ( А ) (секреторный IgA (sIgA) означает значения в грудном молоке); ( B ) (Секреторные IgA (sIgA) средние значения в стуле).
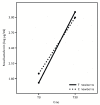
Рисунок 4
Fecal lactoferrin в группах лечения (T) и контроля (C) в моменты наблюдений T0 и T30.
Вторичные результаты показаны на рисунке 5 и рисунке 6 .
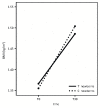
Рисунок 5
Модель роста в группах лечения (T) и контроля (C).
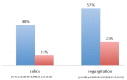
Рисунок 6
Функциональные желудочно-кишечные расстройства (FGID) в группах лечения (T) и контроля (C).
Анализ sIgA
Анализ sIgA в грудном молоке и образцы новорожденных стула показаны на рисунке 3 .
В грудном молоке средние значения sIgA уменьшались от T0 до T30 в обеих группах без каких-либо статистически значимых различий ( рисунок 3 A) (временный эффект: F = 22,69, p <0,001, эффект лечения F = 3,57, p = 0,08, эффект взаимодействия F = 1,35, p = 0,26).
В новорожденных табуретах sIgA увеличился с T0 до T30 в обеих группах. Средние значения были выше у новорожденных, чьи матери взяли пробиотический продукт, чем в контрольной группе ( Рисунок 3 B) (Временной эффект: F = 15, p = 0,02, лечебный эффект: F = 10,62, p = 0,005, эффект взаимодействия: F = 15, p = 0,69).
Дискуссия
В этом исследовании мы оценили средние значения в молозиве и зрелом молоке двух противовоспалительных цитокинов, TGF-β1 и IL-10 и два провоспалительных цитокина, IL-1β и IL-6.
Наши данные показывают значительное временное увеличение грудного молока TGF-β1 у матерей, дополненных пробиотиками, по отношению к контрольной группе ( рисунок 2 D). Кроме того, среднее значение IL-10 как в молозиве, так и в зрелом молоке было выше у дополненных матерей, чем в контрольной группе ( рисунок 2 B). Благотворный эффект этого пробиотического препарата на профили противовоспалительных цитокинов грудного молока не зависит от способа доставки, а только от пробиотического введения матерям.
В раннем детстве TGF-β1, вероятно, оказывает решающее влияние на развитие незрелого желудочно-кишечного тракта, влияя на продукцию IgA и индукцию толерантности к ротовой полости [ 15 ]. На основании известной роли TGF-β1 на уровне sIgA [ 16 ], которая служит в качестве первой линии защиты при иммунитете слизистой оболочки кишечника [ 17 ], можно предположить, что увеличение уровней TGF-β1 в грудное молоко, вызванное этим препаратом пробиотика с высокой дозой, может быть ответственным за значительно более высокие уровни sIgA, обнаруженные в стуле младенцев, чьи матери взяли пробиотический продукт при T30 ( рисунок 3 B).
Поскольку уровни грудного молока TGF-β1 при T0 не различаются между двумя группами ( рисунок 2 D), более высокие концентрации sIgA при T0 в образцах новорожденных стула с добавленной группой ( рис. 3 B) могут быть ранним выражением слизистой оболочки иммунной системы у развивающегося плода. Амниотическая жидкость содержит уровни IgA, происхождения плода, поддерживая гипотезу о том, что новорожденные проникают в мир, который впервые был омыт в среде, созданной матерью, и, по нашему опыту, под влиянием нашего пробиотического дополнения [ 18 ].
Более того, среднее значение sIgA в материнском молоке выше у обработанных матерей, хотя оно не совсем достигла статистической значимости ( рисунок 3 A).
В недавней статье показано, как цитокины оказывают дифференциальное воздействие на мускариновый рецептор на продольную гладкую мышцу кишечника и объясняют основу для изменения подвижности кишечника и сократимости мышц кишечным воспалением. В этом случае TGF-β1, по-видимому, увеличивает сократимость продольной гладкой мышцы кишечника, что говорит о эффектах против регургитации [ 19 ].
В соответствии с этими результатами наши данные показывают, что новорожденные с более низкой частотой регургитации получали молоко с более высокими концентрациями TGF-β1 по сравнению с новорожденными с более высокой частотой регургитации.
IL-10 играет ключевую роль в поддержании гомеостаза, и на протяжении многих лет хорошо известно, что повышенные уровни IL-10 подавляют воспаление [ 20 ]. Наши данные показывают более высокие средние значения IL-10 как в молозиве, так и в зрелом молоке у матерей, дополненных пробиотиками, по сравнению с контрольной группой ( рисунок 2 D). Другие исследования продемонстрировали эффективность некоторых штаммов бактерий, выбранных для их способности повышать уровни IL-10 цитокинов, в профилактике и / или лечении коликов [ 5 ].
Мы можем предположить, что повышенный уровень ИЛ-10 в материнском грудном молоке, вызванный нашим пробиотическим препаратом, может быть причиной уменьшения симптомов колики у младенцев.
При оценке профиля провоспалительных цитокинов наши данные показывают значительное временное снижение ИЛ-6 в материнском молоке у матерей, дополненных пробиотиками, хотя среднее значение в молозиве было значительно выше у матерей, дополненных пробиотиками, по сравнению с контрольной группой , В зрелом молоке уровни IL-6 достигали примерно одинаковых значений контрольной группы. ( Фиг. 2С).
Предыдущее пилотное исследование показало, что концентрация IL-6 в грудном молоке в первые месяцы жизни может сыграть решающую роль в накоплении жира и массы тела [ 21 ]. По мнению авторов, концентрация IL-6 в грудном молоке имела повсеместные отрицательные ассоциации с ростом младенцев и ожирением. Наши данные не дают убедительных доказательств корреляции между концентрацией IL-6 в грудном молоке и младенческим BMI, хотя тенденция снижения, не статистически значимая, наблюдается на T30. Дальнейшие исследования с более длительным наблюдением необходимы для лучшего уточнения этой гипотезы.
Что касается среднего значения IL-1β, мы обнаружили небольшое снижение значения между молозивом и зрелым молоком без статистически значимых различий между пробиотическими добавленными матерями и контрольной группой ( рисунок 2 A).
Наконец, наши результаты показывают, что вводимые пробиотические микроорганизмы не влияют на концентрацию фекального лактоферрина в исследуемых временных точках ( рис. 4 ). Согласно нашим предыдущим данным [ 22 ], концентрация фекалий лактоферрина чрезвычайно высока у младенцев и значительно возрастает от T0 до T30. Этот рост происходит, когда концентрация лактоферрина в грудном молоке уменьшается в продольном направлении [ 5 ].
Наши результаты, наконец, указывают на то, что устные добавки пробиотиков к матерям в перинатальный период могут также иметь последствия для безутешного плач и регургитации в первый месяц жизни, однако эти данные нельзя считать окончательными, поскольку мощность расчета размера выборки не была адекватной для оценки различий между групп.
В нашем предыдущем исследовании мы не наблюдали каких-либо существенных различий в составе микробиоты новорожденных кишечников между плацебо и контрольными группами, что указывает на то, что добавление пробиотиков для матери не изменяет количество полезных для кишечника полезных бактерий у новорожденных. Это также подтверждает гипотезу о том, что колонизация кишечника не может быть существенной для пробиотических биологических эффектов.
Благотворное влияние материнской пробиотической добавки на неонатальный желудочно-кишечный дискомфорт, по-видимому, зависит от различий в профиле цитокинов в грудном молоке.
Идти к:
Выводы
Наше исследование демонстрирует, что добавление к матери с этим специфическим высококонцентрированным пробиотическим препаратом модулирует цитокины в молочной железе и синтез sIgA в слизистой оболочке новорожденных. Было также продемонстрировано, что эта добавка к матерям может снизить начало функциональных симптомов желудочно-кишечного тракта.
Однако стандартное добавление пробиотиков с высокими дозами во время беременности и лактации не может быть рекомендовано. Дальнейшие исследования в этой области необходимы для подтверждения наших результатов и выявления матерей, которые могут получить преимущества от перинатальной добавки. Недавно было продемонстрировано, что мать с FGID может предрасполагать своих детей к FGID [ 23 ]. Основываясь на наших результатах, было бы интересно проверить, можно ли предложить раннее добавление пробиотиков с высокими дозами для матерей, страдающих от FGID.
Идти к:
Подтверждения
Авторы с благодарностью признают финансовую поддержку NOPAIN ONLUS для покрытия расходов на публикацию. Кроме того, мы хотим поблагодарить Клаудио Де Симоне, который одарен активным учебным продуктом без какой-либо роли в разработке и проведении исследования; сбор, управление, анализ или интерпретация данных; подготовка, рассмотрение или утверждение рукописи и решение о представлении рукописи для публикации.
Идти к:
Сокращения
В этой рукописи используются следующие сокращения:
| Ig | иммуноглобулин |
| LAB | Молочнокислые бактерии |
| переменный ток | Аккремовая целлюлаза |
| сИгА | Секреторный IgA |
| Иллинойс | Интерлейкин |
| TGF-β1 | Трансформирующий фактор роста-β1 |
| Hb | гемоглобин |
| FGIDs | Функциональные желудочно-кишечные расстройства |
| BMI | Индекс массы тела |
Идти к:
Авторские вклады
Мария Элизабетта Бальдассарр концептуализировала и разработала исследование; сбор, анализ и интерпретация данных; и рассмотрел первоначальную рукопись. Она имела полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных. Антонио Ди Мауро внес существенный вклад в интерпретацию данных, подготовил первоначальную рукопись и пересмотрел рукопись; Доменико Мартинелли, Флавия Урбано, Паола Мастромарино и Даниэле Капобианко внесли существенный вклад в разработку и разработку исследования, а также за сбор и интерпретацию данных, а также рассмотрели и пересмотрели рукопись; Маргерита Фанелли внес существенный вклад в концепцию и дизайн исследования, а также за проведение анализа и интерпретации данных. Никола Лафоргия внес существенный вклад в разработку концепции и дизайна исследования, а также за проведение интерпретации данных, пересмотра и пересмотра рукописи. Все авторы утвердили окончательную рукопись, представленную.
Введение многофазного пробиотического продукта женщинам в перинатальном периоде по-разному влияет на профиль цитокинов грудного молока и может иметь полезные эффекты на неонатальные функциональные симптомы желудочно-кишечного тракта. Рандомизированное клиническое испытание
Мария Элизабетта Бальдассарр , 1, * Антонио Ди Мауро , 1 Паола Мастрорарино , 2 Маргерита Фанелли , 3Доменико Мартинелли , 1 Флавия Урбано , 1 Даниэла Капобианко , 2 и Никола Лафоргия 1
Информация об авторе ► Примечания к материалам ► Информация об авторских правах и лицензии ►
Эта статья была приведена в других статьях в PMC.
Идти к:
Абстрактные
Справочная информация. Пробиотические добавки к женщинам во время беременности и лактации могут модулировать состав грудного молока, при этом иммунные преимущества передаются их младенцам. Цель: Цель исследования заключалась в оценке влияния высокодозовых пробиотических добавок на женщин во время поздней беременности и лактации на профиль цитокинов и секреторного IgA (sIgA) в грудном молоке и, таким образом, для изучения того, могут ли различия в составе грудного молока влиять на лактоферрин и уровни sIgA в образцах стула новорожденных. Была также оценена безопасность применения пробиотиков для материнства на фоне роста новорожденных и желудочно-кишечных симптомов. Методы. В двойном слепом плацебо-контролируемом рандомизированном исследовании 66 женщин принимали либо пробиотик ( n = 33), либо плацебо ( n= 33) ежедневно. Уровни интерлейкинов (IL-6, IL-10 и IL-1β), трансформирующие фактор роста-β1 (TGF-β1) и sIgA в грудном молоке; и уровень sIgA и лактоферрина в образцах новорожденных стула анализировали при рождении, а затем снова на один месяц жизни. Также проводилась антропометрическая оценка и анализ желудочно-кишечных осложнений у новорожденных. Результаты. Пробиотическое потребление матери оказало значительное влияние на средние значения IL6 в молозиве и на значения IL10 и TGF-β1 в зрелом грудном молоке. Значения Fecal sIgA были выше у новорожденных, чьи матери взяли пробиотический продукт, чем в контрольной группе. Пробиотическая добавка к матерям, по-видимому, снижает заболеваемость инфантильными коликами и регургитацией у младенцев. Вывод:
Ключевые слова:педиатрическая гастроэнтерология, пробиотики / пребиотики, иммунология, функциональные заболевания ГИ
Идти к:
Введение
В нескольких работах показано, что пробиотические добавки к женщинам во время беременности и лактации могут модулировать микробную молочную композицию и уровень разного иммунитета грудного молока и модулирующих иммунитет молекул, при этом выгоды для здоровья варьируются от желудочно-кишечных симптомов до аллергии, передаваемых детям [ 1 ] ,
Наши ранее опубликованные исследования показали, что один и тот же высококонцентрированный пробиотик с множественной деформацией, дополненный матерями в перинатальном периоде, был связан с модуляцией вагинальной микробиоты и секреции вагинальных цитокинов [ 2 ] и с увеличением уровней бифидобактерий грудного молока и лактобациллы у женщин с вагинальными родами, независимо от концентрации молока в функциональных компонентах, таких как олигосахариды и лактоферрин [ 3 ].
Улучшенная микробная молочная композиция может иметь важные последствия для здоровья новорожденного [ 4 ]. Однако мы не обнаружили никакой корреляции между количеством бифидобактерий и лактобацилл в материнском грудном молоке и уровнями в фекалиях младенцев [ 5 ].
Мы предположили, что цитокины и другие иммунорегуляторные факторы, модулированные пробиотическими добавками, могут сыграть ключевую роль в создании микробиоты человеческого молока.
Первичные результаты этого исследования состояли в том, чтобы оценить, могут ли дополнения материнской пробиотики модулировать профиль цитокинов и секреторный IgA (sIgA) в грудном молоке и, таким образом, изучать, могут ли различия в составе грудного молока влиять на уровни лактоферрина и sIgA в образцах новорожденных кала.
Наш вторичный результат состоял в оценке безопасности высококонцентрированного введения пробиотиков у матерей для новорожденных, оценки роста и появления наиболее частых желудочно-кишечных симптомов у младенцев. Высказывалось предположение, что перинатальная манипуляция микробиотой кишечника с помощью пробиотиков может привести к снижению функциональных симптомов желудочно-кишечного тракта [ 6 ].
Предыдущее исследование показало, что раннее введение пробиотика в раннем возрасте может предотвратить появление функциональных симптомов желудочно-кишечного тракта у новорожденных [ 7 ]. Правильный механизм действия пробиотиков в этой области до сих пор не выяснен, но он, по-видимому, опосредуется активностью на синдром внутренних чувствительных нейронах с улучшением подвижности кишечника, а также положительным эффектом на функцию и висцеральную боль [ 8 ] , В последнее время исследование на крысах позволило выявить новые регуляторные механизмы и специфические закономерности гениальной экспрессии, вызванные воздействием одного и того же высокопрочного пробиотика с высокой концентрацией, который может иметь клинические показания при висцеральной боли [ 9]. Кроме того, важно отметить, что преимущества для здоровья, предоставляемые бактериями пробиотиков, специфичны для штаммов.
Идти к:
Экспериментальная секция
Дизайн исследования и пациенты
Это было двойное слепое рандомизированное плацебо-контролируемое клиническое исследование (клиническое исследование: NCT01367470 ), выполненное для оценки влияния введения пробиотиков на материнскую схему на цитокинов грудного молока и производства sIgA.
Пациенты и методы подробно описаны в нашей предыдущей статье, где мы оценивали влияние пероральных пробиотических добавок на женщин на уровни грудного молока полезных бактерий [ 4].
Здоровые беременные женщины в возрасте 18-44 лет, которые были допущены с низким уровнем акушерского риска в Отделе акушерства и гинекологии, Отделе биомедицинской и онкологической науки человека (DIMO), Университете Бари, Бари, Италия в период с апреля 2011 года и Декабрь 2013 года, были зарегистрированы.
Критерии исключения: (а) ранее существовавшие клинические состояния, такие как диабет, гипертония, аутоиммунные заболевания, астма, аллергии, почечные или печеночные заболевания, вирусная, бактериальная или простейшая инфекция, анемия (гемоглобин, Hb <10 г / л); (б) двойная беременность; (c) беременность и преждевременные роды; d) курение более 10 сигарет в день; (д) использование других пробиотиков во время протокола исследования.
Информированное согласие было получено при зачислении в соответствии с местным комитетом по этике (Университет Бари, Поликлиническая больница Бари, Медицинская школа, BARI, Италия), которая рассмотрела и одобрила протокол исследования.
Все зарегистрированные женщины были рандомизированы для приема пероральных пробиотиков или добавок к плацебо ежедневно, за четыре недели до ожидаемой даты доставки (36-я неделя беременности) до четырех недель после родов. Рандомизация выполнялась с использованием компьютерной последовательности выделения. Все участники, а также научный и медицинский персонал, предназначенные для изучения и распространения исследовательских агентов, или оценки образцов и анализов, были ослеплены групповым назначением.
Использовалась высококонцентрированная пробиотическая добавка с высокой концентрацией, состоящая из пакетов, содержащих 900 миллиардов жизнеспособных лиофилизированных бактерий из четырех различных штаммов лактобацилл ( L. paracasei DSM 24733, L. plantarum DSM 24730, L. acidophilus DSM 24735 и L. delbrueckii subsp. bulgaricus DSM 24734), три штамма бифидобактерий ( B. longum DSM 24736, B. breve DSM 24732 и B. infantis DSM 24737) и один штамм Streptococcus thermophilus DSM 24731, произведенный в Danisco-Dupont, WI, USA и в настоящее время продается в континентальной Европе и США под брендами Vivomixx ® и Visbiome® , соответственно.
Плацебо состояло из кукурузного крахмала и было идентичным по сенсорным свойствам, чтобы поддерживать двойной слепой статус.
Диетолог дал диетическое руководство каждой матери, согласно собранным антропометрическим значениям и диетическое интервью в конце первого триместра беременности. Никаких конкретных диетических ограничений во время беременности и лактации не рекомендовалось, за исключением других коммерческих продуктов, содержащих пробиотики.
Матери, которые рожали кесаревым сечением, получали однокорпусную дозу 2 г цефалоспорина третьего поколения.
Характеристики матери и новорожденного были собраны в начале исследования.
Анализ грудного молока
Чтобы оценить, модулирует ли пробиотические добавки для материнства профиль цитокинов и sIgA в материнском молоке, два образца материнского молока были собраны путем ручной экстракции: молозиво в течение 72 часов после родов (T0) и зрелого молока через 30 дней после родов (T30).
Уровни интерлейкинов (IL-6, IL-10 и IL-1β) и трансформирующий фактор роста-β1 (TGF-β1) анализировали с использованием коммерческих наборов иммуноферментного анализа (ELISA) (CLB Pelikine Compact, Research Diagnostics Inc., Flandern, NJ, USA и R & D Systems Inc., Миннеаполис, Миннесота, США, соответственно) в соответствии с рекомендациями производителя. Все образцы были проанализированы в двух экземплярах. Значения выражены в мкг / мл. Уровни IgA определяли с помощью нефелометрии (анализатор нифелометра Беринга, Dade-Behring, Марбург, Германия).
