Коллоидообразование и его роль в качественном анализе
Механизм образования осадков достаточно сложен и включает ряд стадий, которые протекают последовательно, начиная с момента смешения растворов (рис. 1). Если выполняется условие образования осадка ПС > ПР, то через определённое время после смешения растворов (индукционный период) начинается зародышеобразование. В результате образуются первичные кристаллы осадка – зародыши. Затем идёт агрегация – соединение зародышей в более крупные агрегаты. При этом образуется коллоидный раствор, содержащий частицы осадка размером 10–5–10–7 см. Частицы продолжают укрупняться. Одновременно с агрегацией происходит ориентация диполей:
 |  | ||||
 | |||||
В результате этих процессов начинается осаждение. Если скорость ориентации (Vор) больше скорости агрегации (Vагр), то выпадает кристаллический осадок, а если скорость агрегации больше скорости ориентации, то аморфный.
Смешение растворов  | Индук- ционный период | |||
 ПС > ПР ПС > ПР | ||||
 Зародышеобразование Зародышеобразование |  Первичные кристаллы (зародыши) Первичные кристаллы (зародыши) | Образо-вание осадка | ||
 |   | |||
| Агрегация |   | Коллоидный раствор | ||
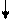 | ||||
| Осаждение | Кристаллический (Vор>Vагр) или аморфный (Vагр>Vор) осадок |
Рис. 1. Механизм образования осадков
Таким образом, коллоидообразование – это промежуточная стадия образования любого осадка. Процесс перехода коллоидного раствора в осадок называется коагуляцией, а обратный ему процесс – пептизацией.
Свойства коллоидных растворов отличаются от свойств истинных растворов и суспезий – растворов, содержащих твёрдые взвешенные частицы. Сравнительная характеристика свойств, важных для химика-аналитика, приведена в табл. 1.
Таблица 1
Сравнительная характеристика свойств
коллоидных растворов, истинных растворов и суспензий
| Суспензия | Коллоидный раствор | Истинный раствор |
| размер частиц ³ 10–5 см | размер частиц 10–5–10–7 см | размер частиц £ 10–7 см |
| осаждение частиц происходит | осаждение частиц не происходит | |
| частицы задерживаются бумажным фильтром, центрифугируются | частицы не задерживаются бумажным фильтром, не центрифугируются |
Отсюда следует, что в случае коллоидообразования осадок не выпадает, его нельзя отделить от раствора фильтрованием или центрифугированием, в то время как большинство разделений в качественном анализе проводится именно с использованием реакций осаждения. Следовательно, коллоидообразование играет отрицательную роль в анализе и химику-аналитику необходимо предпринимать специальные меры с целью коагуляции коллоидных растворов.
Коагуляции способствуют:
ü наличие в растворе сильного электролита;
ü нагревание раствора;
ü перемешивание раствора.
Например, осаждение катионов III группы в виде сульфидов, которые склонны к образованию коллоидных растворов, ведут из горячих растворов при непрерывном перемешивании и в присутствии электролита-коагулятора NH4Cl.
Однако в ряде случаев коллоидообразование играет положительную роль в качественном анализе, т. к. при этом увеличивается чувствительность реакций и становится возможным обнаружение следовых количеств веществ. Например, малые количества иона NH4+ невозможно открыть реакцией со щёлочью, но можно обнаружить по жёлто-бурому окрашиванию коллоидного раствора, полученного при действии на пробу реактива Несслера.
Органические аналитические реагенты и их применение
в качественном анализе
Органические реагенты (ОР) – это органические соединения, вступающие в реакции с веществами неорганической или органической природы с образованием продуктов, обладающих аналитическими свойствами.
ОР широко используют в аналитической химии благодаря ряду их преимуществ перед неорганическими реагентами:
1) высокая избирательность действия. По этой причине многие ОР являются специфическими реагентами на неорганические ионы. Например, реактив Грисса является специфическим ОР на нитрит-ионы NO2–;
2) высокая чувствительность реакций с участием ОР, что позволяет обнаружить вещество в очень малых концентрациях.
Высокая чувствительность и селективность органических реагентов обусловлены их высокой молярной массой, низкой растворимостью в воде комплексов органических реагентов с ионами металлов, а также интенсивной окраской таких комплексов.
В качественном анализе органические реагенты применяют для:
ü обнаружения с использованием реакций осаждения и реакций, протекающих с образованием окрашенных продуктов;
ü маскирования мешающих ионов с целью подавления побочных реакций аналитического реагента с посторонними ионами, присутствующими в анализируемом растворе.
Обнаружение катионов и анионов осуществляется с помощью органических реагентов, образующих с открываемыми ионами комплексные соединения с интенсивной характерной окраской. Наиболее часто для этой цели используют ализарин (реагент на ион Al3+), дифенилкарбазид (реагент на ион Cr3+), диметилглиоксим (реагент на ион Ni2+), дитизон (реагент на ион Zn2+), дифениламин (реагент на ион NO3-) и др.
Маскирование проводят, используя органические комплексообразующие реагенты. Например, Fe3+ мешает определению никеля с диметилглиоксимом в аммиачных растворах из-за осаждения гидроксида Fe(ОН)3. Для маскирования ионов Fe3+ к анализируемому раствору добавляют винную, щавелевую или лимонную кислоту, которые связывают их в бесцветные растворимые комплексы.
Кроме органических реагентов, в качественном анализе применяют также органические растворители. Их используют для приготовления растворов органических реагентов и проведения экстракции. Например, раствор дитизона для обнаружения ионов Zn2+ готовят на хлороформе или четырёххлористом углероде. При экстракции вещество переходит из одной жидкой фазы (чаще всего – водного раствора) в другую (органическую), которая не смешивается с ней. Примером использования экстракции в качественном анализе является реакция обнаружения иодид-ионов:
2I– + Cl2 = I2 + Cl–.
Образовавшийся продукт реакции I2 плохо растворяется в воде, поэтому аналитический эффект реакции – появление жёлто-бурой окраски раствора выражен очень слабо. Однако если провести последующую экстракцию I2 в органическую фазу (хлороформ, бензол), то слой органического растворителя приобретает характерную для I2 интенсивную фиолетово-розовую окраску. Причина заключается в том, что неполярное вещество I2 лучше растворяется в неполярном органическом растворителе, чем в полярном (воде).
