Титриметрические методы анализа
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ
Пример 1. На титрование 10,00 мл раствора КОН затрачено 15,50 мл 0,1028 М раствора HCl . Вычислить молярную концентрацию раствора КОН.
Решение. Вещества реагируют в эквимолярных количествах, поэтому в точке стехиометричности:
n(HCl) = n(KOH) ; VHCl∙c(HCl) = VKOH∙c(KOH)
Из полученного равенства находим неизвестную концентрацию:
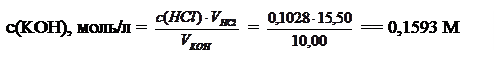
Ответ: c(KOH) = 0,1593 M.
Пример 2.Вычислить массу серной кислоты в 500,0 мл раствора, на титрование 25,00 мл которого израсходовано 22,50 мл 0,0951 М раствора КОН.
Решение. По закону эквивалентов:
с(1/2 H2SO4)∙ 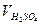 = с(KOH)∙VKOH;
= с(KOH)∙VKOH;
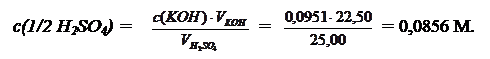
Молярная масса эквивалента H2SO4 равна произведению ее молярной массы на фактор эквивалентности: M(1/2 H2SO4) = 98,08 ∙ 1/2 = 49,04 г/моль. В 500,00 мл раствора H2SO4 содержится:
m(H2SO4) = c(1/2 H2SO4)∙M(1/2 H2SO4)∙V 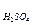 ∙10-3.
∙10-3.
m(H2SO4) = 0,0856∙49,04∙500,00∙10-3 =2,0989 г.
Или используем для расчета формулу вычисления массы определяемого вещества по объему титранта:
m(В) = VA ∙ cэ(A) ∙ Mэ(В) ∙10-3.
m(H2SO4) = VKOH ∙ c(КОН) ∙ M(1/2 H2SO4) ∙ Р ∙10-3 = 22,50 ∙ 0,0951 ∙ 49,04 ∙ 500/25 ∙ 10-3 = 2,0989 г,
где Р – разбавление, т.е. отношение общего объема раствора к объему его аликвотной части.
Ответ: m(H2SO4) = 2,0989 г.
Пример 3.На титрование 10,50 мл аммиака затрачено 12,85 мл раствора HCl, в 1 мл которого содержится 0,004572 г HCl. Вычислить массу NH3 в 200,0 мл этого раствора.
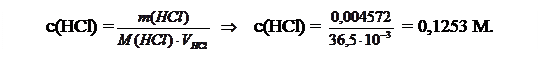 Решение. М(HCl) = 36,5 г/моль. Можно найти с(HCl), используя следующую зависимость:
Решение. М(HCl) = 36,5 г/моль. Можно найти с(HCl), используя следующую зависимость:
В точке стехиометричности:
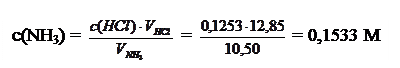
Масса NH3 в 200,0 мл раствора рассчитывается по формуле:
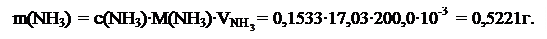
Ответ: m(NH3) = 0,5221 г.
Пример 4. В приборе для отгонки аммиака раствор (NH4)2SO4 обработан при нагревании раствором NaOH. Выделившийся аммиак поглощен 50,0 мл раствора серной кислоты с концентрацией с(1/2 H2SO4) = 0,2000 М. Полученный раствор оттитрован 22,50 мл 0,2500 М раствора NaOH. Рассчитать массу сульфата аммония в анализируемом растворе.
Решение. Когда прямое определение невозможно, применяют обратное титрование. При добавлении к раствору (NH4)2SO4 раствора NaOH протекает реакция:
(NH4)2SO4 + 2NaOH = Na2SO4 + 2H2O + 2NH3↑
В точке стехиометричности все количество серной кислоты затрачено на взаимодействие с аммиаком и гидроксидом натрия, отсюда следует:
 n(1/2(NH4)2SO4) = n(1/2H2SO4) – n(NaOH);
n(1/2(NH4)2SO4) = n(1/2H2SO4) – n(NaOH);
M(1/2(NH4)2SO4) = 66,08 г/моль;
m((NH4)2SO4) = (0,2000∙50,0 – 0,2500∙22,50)∙66,08∙10-3 = 0,2891 г.
Ответ: m((NH4)2SO4) = 0,2891г.
Пример 5. Навеску технической щавелевой кислоты (1,9800 г) растворили и довели объем водой до 500,0 мл. На титрование 25,00 мл полученного раствора пошло 18,55 мл 0,0984 М раствора NaOH. Вычислить массовую долю H2C2O4 в образце.
Решение. Щавелевая кислота взаимодействует с гидроксидом натрия по уравнению:
H2C2O4 + 2NaOH = Na2C2O4 +2H2O
 fэкв(H2C2O4) = 1/2; М(1/2 H2C2O4) = 90,0/2 = 45,0 г/моль.
fэкв(H2C2O4) = 1/2; М(1/2 H2C2O4) = 90,0/2 = 45,0 г/моль.
Массу щавелевой кислоты вычисляем по уравнению:
m(H2C2O4) = VNaOH∙c(NaOH)∙М(1/2 H2C2O4)∙Р∙10-3,
где Р – это разбавление, равное отношению общего объема раствора к объему оттитрованной аликвотной части .
m(H2C2O4) = 18,55∙0,0984∙45,0 ∙500,0/25,00∙10-3 = 1,63384 г;
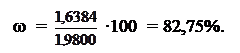
Ответ: ω(H2C2O4) = 82,75%.
Пример 6.На титрование 0,5060 г технического CaCl2 израсходовано 18,10 мл 0,1020 М раствора ЭДТА. Рассчитать массовую долю CaCl2 в анализируемом препарате.
Решение. Так как ЭДТА реагирует с большинством ионов металлов в стехиометрическом соотношении 1:1, можно использовать в расчетах молярную концентрацию ЭДТА и молярную массу определяемого соединения. M(CaCl2) = 111,0 г/моль. Вычисляем массу CaCl2 в пробе по уравнению:
m(CaCl2) = c(ЭДТА )∙VЭДТА∙M(CaCl2)∙10-3 = 0,1020∙18,10∙111,0∙10-3 = 0,2049г.
Массовая доля CaCl2 в препарате:
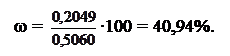
Ответ: ω(CaCl2) = 40,94 мас.%.
Пример 7.На титрование 150,0 мл водопроводной воды при рН 9 израсходовали 12,40 мл, а при рН 12 – 6,80 мл раствора ЭДТА с концентрацией с(ЭДТА) = 0,0200 моль/л. Рассчитать общую жесткость воды и жесткость, обусловленную присутствием ионов кальция и магния.
Решение. Для вычисления жесткости воды используют молярную концентрацию эквивалента ЭДТА:
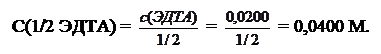
При рН 9 с индикатором эриохром черный Т определяют общую жесткость воды:
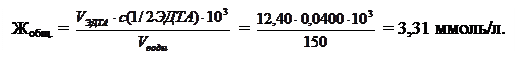
При рН 12 с индикатором мурексид определяют жесткость, обусловленную присутствием кальция в воде:

ЖMg = Жобщ.- ЖСа = 3,31 – 1,81 = 1,50 ммоль/л.
Ответ: Ж общ.= 3,31 ммоль/л, ЖСа = 1,81 ммоль/л, ЖMg = 1,50 ммоль/л.
Пример 8. Вычислить массу навесок препаратов: а) MgSO4∙7H2O; b) CaCO3; c) FeNH4(SO4)2∙12H2O, необходимую для приготовления 250,0 мл раствора с молярной концентрацией эквивалента 0,0500 моль/л.
Решение: Независимо от степени окисления металла в реакции с ЭДТА выделяется два иона водорода, стехиометрическое отношение Ме:ЭДТА = 1:1, поэтому fэкв.(ЭДТА) = fэкв(Ме) = 1/2. Массу навесок вычисляем по формуле:
m(Me) = М(1/2Me)∙c(1/2Me)∙V∙10-3 ;
a) m(MgSO4∙7H2O) = M(1/2 MgSO4∙7H2O)∙c(1/2∙MgSO4)∙V∙10-3 =
1/2 ∙246,5∙0,0500∙250,0∙10-3 = 1,5406 г.
b) m(CaCO3) = M(1/2 CaCO3)∙c(1/2 CaCO3)∙V∙10-3 = 1/2∙100∙250,0∙0,0500∙10-3 = 0,6250 г.
c) m(FeNH4(SO4)2∙12H2O) = M(1/2 FeNH4(SO4)2∙12H2O)∙c(1/2 FeNH4(SO4)2)∙V∙10-3 = 1/2∙481,84∙250,0∙0,0500∙10-3 = 3,0115 г.
Ответ: а) 1,5406 г; b) 0,6250 г; с) 3,0115 г.
Пример 9. Сколько грамм технического KMnO4 необходимо взять для приготовления 5,00 л раствора с молярной концентрацией эквивалента 0,02 М для титрования в кислой среде, если технический препарат содержит 97,3% KMnO4.
Решение: В кислой среде MnO4- восстанавливается до Mn2+ :
Mn7+ + 5e → Mn2+ 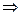 fэкв.(KMnO4) = 1/5,
fэкв.(KMnO4) = 1/5,
М(1/5 KMnO4) = 1/5∙158,03 = 31,61г/моль;
m.(KMnO4) = c(1/5 KMnO4) ∙ 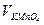 ∙M(1/5 KMnO4) = 0,02∙5,00∙31,61 = 3,161 г.
∙M(1/5 KMnO4) = 0,02∙5,00∙31,61 = 3,161 г.
 Т.к. в техническом препарате содержится 97,3% KMnO4, то масса навески в г должна составить:
Т.к. в техническом препарате содержится 97,3% KMnO4, то масса навески в г должна составить:
Ответ: m.(KMnO4) = 3,2487 г.
Пример 10. Навеску руды 0,2050 растворили в серной кислоте. Содержащееся в пробе железо восстановили до Fe2+ и оттитровали раствором KMnO4 с молярной концентрацией эквивалента 0,1218 М. Найти массовую долю Fe в руде, если известно, что на титрование израсходовано 5,20 мл раствора KMnO4.
Решение. В кислой среде MnO4- восстанавливается до Mn2+, Fe2+ до Fe3+:
Mn7+ + 5e → Mn2+ 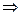 fэкв.(KMnO4) = 1/5;
fэкв.(KMnO4) = 1/5;
Fe2+ + 1e → Fe3+ 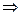 fэкв.(Fe) = 1; М(Fe) = 55,84;
fэкв.(Fe) = 1; М(Fe) = 55,84;
m(Fe) = c(1/5 KMnO4)∙ 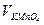 ∙M(Fe)∙10-3 = 0,1218∙15,20∙55,84∙10-3 = 0,1034 г;
∙M(Fe)∙10-3 = 0,1218∙15,20∙55,84∙10-3 = 0,1034 г;

Ответ: ω(Fe) =50,44%.
