Окислительно-восстановительных реакций
(метод электронно-ионного баланса)
1. Записать уравнение реакции, определить степень окисления каждого элемента и найти элементы, которые в результате реакции изменяют степень окисления, выделить окислитель и восстановитель.
2. Составить полуреакции окисления и восстановления с учетом правил написания ионных уравнений: слабые электролиты, неэлект-ролиты, труднорастворимые соединения записываются в молеку-лярном виде, а сильные электролиты – в ионном.
3. Уравнять число атомов каждого элемента в левой и правой частях полуреакций. При этом в водных растворах в реакциях могут участвовать молекулы воды, ионы водорода или гидроксида.
Уравнивание кислорода происходит по-разному в кислой, нейтральной и щелочной средах.
В кислой среде в ту часть уравнения, где недостаток кислорода, следует приписать столько молекул H2O, каков недостаток кислорода, а в противоположную часть полуреакции – соответству-ющее число ионов водорода.
В щелочной среде в ту часть уравнения, где кислород в недостатке, следует записать вдвое больше ионов гидроксида, чем не хватает кислорода, а в противоположную часть полуреакции – соответствующее число молекул Н2О.
В нейтральной среде прием уравнивания зависит от продуктов реакции.
4. Суммарное число зарядов в обеих частях каждой полуреакции должно быть одинаковым. Это достигается путем добавления к левой части или отнятия от левой части полуреакции необходимого числа электронов.
5. Составить электронный баланс, т.е. соблюдая равенство числа отдаваемых и принимаемых электронов, найти для каждой полуреакции наименьший множитель, который одновременно является определяемым коэффициентом.
6. Сложить уравнения полуреакций с учетом найденных коэффициентов и сократить, если необходимо, в обеих частях результирующего уравнения одинаковые частицы. Коэффициенты перенести в уравнение химической реакции.
7. Определить недостающие коэффициенты в уравнении реакции, последовательно уравнивая число атомов металлов, затем неметаллов и водорода.
8. Проверить правильность расстановки коэффициентов в уравнении реакции по числу атомов кислорода в левой и правой частях уравнения.
Пример 3. Уравнять методом полуреакций окислительно-восстановительную реакцию:
FeSO4 + KMnO4 + H2SO4 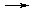 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Решение.
|
|
|
|
|
|
|
FeSO4 + KMnO4 + H2SO4 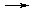 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Видно, что в ходе реакции степень окисления железа повышается от +2 до +3 (процесс окисления), а марганца, входящего в кислотный остаток, – понижается от +7 до +2 (процесс восстановления).
Таким образом:
2Fe2+ - 2ē 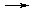 2Fe3+ (полуреакция окисления).
2Fe3+ (полуреакция окисления).
Для составления уравнения полуреакции восстановления используется схема:
MnO4- 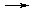 Mn2+.
Mn2+.
В правой части не хватает четырех атомов кислорода, следовательно, в правую часть следует прибавить четыре молекулы воды, а в левую часть – восемь ионов Н 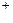 :
:
MnO4- + 8H+ 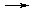 Mn2+ + 4H2O.
Mn2+ + 4H2O.
Суммарный заряд левой части равен +7, заряд правой части +2. Чтобы заряд левой части был равен заряду правой части, необходимо прибавить к левой части пять электронов:
MnO4- + 8H+ + 5ē 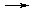 Mn2+ + 4H2O.
Mn2+ + 4H2O.
Отношение числа электронов, отданных при окислении железа и принятых при восстановлении марганца, составляет 2:5, следова-тельно, складывая уравнения двух полуреакций, необходимо первое умножить на 5, а второе на 2:
2Fe2+ – 2ē 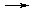 2Fe3+ 2Fe3+ | |
MnO4- + 8H+ + 5ē 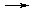 Mn2+ + 4H2O Mn2+ + 4H2O | |
10Fe2+ + 2MnO4- + 16H+ 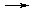 10Fe3+ + 2Mn2+ + 8H2O 10Fe3+ + 2Mn2+ + 8H2O |
В молекулярной форме уравнение имеет следующий вид:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Пример 4.Уравнять методом полуреакций следующую окислительно-восстановительную реакцию:
NaCrO2 + Br2 + NaOH 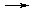 Na2CrO4 + NaBr + H2O.
Na2CrO4 + NaBr + H2O.
|
|
|
|
|
| |
NaCrO2 + Br2 + NaOH 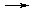 Na2CrO4 + NaBr + H2O.
Na2CrO4 + NaBr + H2O.
В ходе реакции степень окисления хрома, находящегося в кислотном остатке, повышается от +3 до +6 (процесс окисления), а брома понижается от 0 до −1 (процесс восстановления).
Таким образом:
Вr2 + 2ē 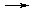 2Br- (полуреакция восстановления).
2Br- (полуреакция восстановления).
Для составления уравнения полуреакции окисления используется схема:
CrO2- 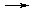 CrO42-.
CrO42-.
В левой части не хватает двух атомов кислорода, следовательно, в левую часть следует прибавить четыре иона ОН– (вдвое больше, чем не хватает кислорода), в правую часть – две молекулы воды:
CrO2- + 4ОН- 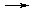 CrO42- + 2H2O.
CrO42- + 2H2O.
Суммарный заряд левой части равен –5, заряд правой части равен –2. Чтобы заряд левой части был равен заряду правой части, необходимо из левой части вычесть три электрона:
CrO2- + 4ОН- – 3ē 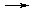 CrO42- + 2H2O.
CrO42- + 2H2O.
Поскольку отношение чисел электронов, отданных при окислении и принятых при восстановлении, равно 3:2, то, складывая уравнения двух полуреакций, первое следует умножить на 2, а второе – на 3:
CrO2- + 4ОН- – 3ē 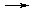 CrO42- + 2H2O CrO42- + 2H2O | |
Вr2 + 2ē 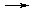 2Br- 2Br- | |
CrO2- + 8ОН- + 3Br2 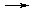 2CrO42- + 4H2O + 6Br- 2CrO42- + 4H2O + 6Br- |
В молекулярной форме уравнение имеет следующий вид:
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O.
