Опыт 1. Получение этилена и его свойства
Реактивы: смесь для получения этилена (смесь 96-процентного этилового спирта и концентрированной серной кислоты в объемном отношении 1:2), бромная вода (насыщенная), 2-процентный раствор КМО4, 10-процентный раствор карбоната натрия.
Оборудование: прибор для получения этилена (рис.2), кипятильники (кусочки битого фарфора, пористой глины, пемзы, кварцевый песок и др.), газоотводные трубки с хлоркальциевыми трубками, заполненными кусочками натронной извести, крышки от тиглей.
а) Реакция этилена с бромной водой. В сухую пробирку наливают 5 мл смеси для получения этилена (этиловый спирт и концентрированная серная кислота в объемном отношении 1:2). При смешивании этанола с серной кислотой образуется этилсерная кислота – кислый сложный эфир.
Напишите уравнение реакции образования этилсерной кислоты.
В реакционную смесь помещают несколько кипятильников (кусочков битого фарфора, кварцевого песка и т.д.) – для равномерного кипения реакционной смеси закрывают пробирку пробкой с газоотводной трубкой и закрепляют ее в штативе. В середину газоотводной трубки вставляют хлоркальциевую трубку с натронной известью, помещенной между двумя неплотными ватными тампонами. Натронная известь должна быть в виде кусочков, газообразные вещества должны свободно проходить через нее (в противном случае может быть несчастный случай: если выход для газов закрыт, под их давлением пробка может выскочить и кипящая реакционная смесь, содержащая концентрированную серную кислоту, будет выброшена из пробирки).
В штатив ставят пробирку с 2 мл бромной воды. Пробирку со смесью для получения этилена осторожно нагревают, следя за тем, чтобы вспенивающуюся жидкость не перебросило в хлоркальциевую трубку. Выделяющийся этилен пропускают через бромную воду, которая быстро обесцвечивается (качественная реакция на кратные связи).
Напишите уравнение реакции образования этилена из этилсерной кислоты (реакция идет при температуре около 1700С). Кроме основной реакции – сернокислотной дегидратации этилового спирта, протекает несколько побочных реакций. Одна из наиболее важных – окислительно-восстановительная. Концентрированная серная кислота при высокой температуре окисляет органическое вещество (в том числе и этанол) до углерода и оксида углерода (IV) – реакционная смесь чернеет. При этом кислота восстанавливается до оксида серы (IV), который может реагировать с бромной водой и с перманганатом калия подобно этилену. Поэтому его отделяют от примеси оксида серы (IV). Кислотные оксиды (SO2, CO2) поглощают натронной известью, помещенной в хлоркальциевую трубку.
Напишите уравнения реакций оксидов SO2 и CO2 с натронной известью. Этен реагирует с бромной водой по электрофильному механизму (АЕ). Рассмотрите его. Какую роль в этой реакции играет вода?
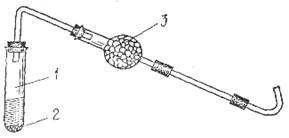
Рисунок 2. Прибор для получения этилена
б) Реакция этена с водным раствором перманганата калия (реакция Е.Е.Вагнера). В пробирку наливают 2 мл 2-процентного раствора калия, добавляют 0,5 мл 10-процентного раствора соды и пропускают этен. Фиолетовая окраска раствора исчезает, образуется хлопьевидный осадок бурого цвета. Если этен пропускать долго, осадок может раствориться. При окислении этена в условии реакции Вагнера образуется двухатомный спирт – этиленгликоль НО-СН2-СН2-ОН.
Напишите уравнение реакции окисления этилена водным раствором перманганата калия. Реакция Вагнера – качественная реакция на кратные связи.
в) Горение этена. Поджигают этен у конца газоотводной трубки (рис. 2). Этен горит светящимся пламенем. Вносят в пламя этена крышку от тигля.
Объясните, почему на крышке образуется черное пятно. Рассчитайте процентное содержание углерода и водорода в молекуле этена. Напишите уравнение реакции горения этена.
Опыт 3. Свойства жидких непредельных углеводородов ряда этена (алкенов)
Реактивы: ненасыщенные жидкие углеводороды, 3-процентный раствор брома в четыреххлористом углероде, 2-процентный раствор перманганата калия, 10-процентный раствор карбоната натрия, концентрированная серная кислота, концентрированная азотная кислота.
Оборудование: синяя лакмусовая бумага, фильтровальная бумага.
а) Бромирование непредельных углеводородов (тяга!). В сухую пробирку наливают 1 мл непредельных углеводородов и добавляют по каплям при встряхивании 3-процентный раствор брома в четыреххлористом углероде. Если желтая окраска исчезает медленно, смесь осторожно подогревают в пламени горелки. К отверстию пробирки подносят влажную синюю лакмусовую бумагу, убеждаются, что цвет ее не меняется. Напишите уравнение реакции присоединения брома к 2-метилбутену-2 и рассмотрите ее механизм (АЕ). Рассчитайте, сколько граммов 3-процентного раствора брома потребуется для бромирования 1 г 2-метилбутена-2.
б) Окисление алкенов водным раствором перманганатом калия (реакция Е.Е.Вагнера). В пробирку наливают 1 мл ненасыщенных углеводородов, добавляют 1 мл 10-процентного раствора соды, затем по каплям при встряхивании – 2-процентный раствор перманганата калия. Фиолетовая окраска раствора исчезает, появляется хлопьевидный осадок бурого цвета.
Напишите уравнение реакции окисления 2-метилбутена-2 водным раствором КМnО4 (подберите коэффициенты). Если исчезновение фиолетовой окраски заметить трудно, в смесь опускают полоску фильтровальной бумаги, которая впитывает лишь раствор, но не осадок. Окраска раствора на фильтровальной бумаге видна отчетливо.
Реакции с бромной водой и с водным раствором перманганата калия – качественные реакции на соединения с кратными связями.
в) Реакция алкенов с концентрированной серной кислотой. В сухую пробирку наливают 1 мл непредельных углеводородов, добавляют 1 мл концентрированной серной кислоты и взбалтывают смесь в течение нескольких минут (вначале осторожно!). Если смесь сильно разогревается, пробирку охлаждают водой. Слой алкена исчезает, смесь приобретает бурую окраску. Напишите уравнение реакции образования алкилсерной кислоты и рассмотрите механизм (АЕ) этой реакции (на примере 2-метилбутена-2).
Реакцией с концентрированной серной кислотой пользуются для очистки предельных углеводородов от примеси непредельных углеводородов.
г) Взаимодействие алкенов с концентрированной азотной кислотой. В сухую пробирку наливают 1 мл ненасыщенных углеводородов, добавляют 1 мл концентрированной азотной кислоты и осторожно перемешивают смесь. Когда реакция замедлится, реакционную смесь энергично встряхивают в течение нескольких минут. Смесь разогревается и становится бурой. Происходит образование сложной смеси продуктов окисления и осмоления. Какими спектральными методами можно обнаружить двойную связь в алкенах?
Экспериментальная задача
В двух пробирках находятся смеси: а) жидких предельных и б) жидких непредельных углеводородов. Определите с помощью качественных реакций, в какой пробирке находятся предельные и в какой непредельные соединения.
Лабораторная работа №3
