Примеры решения типовых задач
ПРИМЕР 1 Для реакции
2KBr + PbO2 + 4HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2H2O
установить направление возможного протекания ее при стандартных условиях.
РЕШЕНИЕ . Запишем уравнение реакции в ионно-молекулярной форме:
2Br- + PbO2 + 4H+ = Pb2+ + Br2 + 2H2O.
Затем представим его в виде полуреакций, с указанием табличных значений ОВ-потенциалов:
2Br- - 2ē = Br2 E0(Br2/Br-) = 1,065 В,
восстановитель
PbO2 + 4H+ + 2ē = Pb2+ + 4H2O E0(Pb2+/PbO2)= 1,449 В
Окислитель
Потенциал окислителя Е0окбольше, чем потенциал восстановителя Е0восс, следовательно, приведенная реакция будет самопроизвольно протекать слева направо.
ПРИМЕР 2.Могут ли в стандартных условиях одновременно находиться в растворе хлориды двухвалентного олова и трехвалентного железа?
РЕШЕНИЕ. Представим данную систему в виде реакции
SnCl2 + FeCl3 = SnCl4 + FeCl2
Определим по таблице значения стандартных электродных потенциалов полуреакций.
Sn2+ - 2 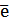 = Sn4+ Е0восс = +0,151 В
= Sn4+ Е0восс = +0,151 В
2 Fe3+ + 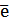 = Fe2+ Е0ок = +0,771 В
= Fe2+ Е0ок = +0,771 В
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
В данном примере Еок > Eвосс, т.е. реакция в стандартных условиях будет протекать самопроизвольно в прямом направлении и, следовательно, указанные хлориды будут реагировать между собой, поэтому одновременное нахождение их в растворе невозможно.
ПРИМЕР 3. Рассчитать константу равновесия окислительно-восстановительной системы при стандартных условиях:
10Br- + 2MnO4- + 16H+ = 5Br2 + 2Mn2+ + 8H2O,
если E0(Br2/Br-) = 1,065В; E0(MnO4-/Mn2+) = 1,507В.
РЕШЕНИЕ. Представим данную реакцию в виде полурекций окисления и восстановления:
2Br- -2ē = 5Br2 Е0восс = 1,065 В,
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O, E0ок = 1,507В
Константа равновесия К окислительно-восстановительной реакции с окислительно-восстановительными потенциалами связана следующим соотношением:
lgК= 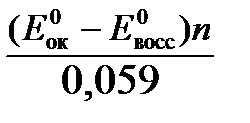 .
.
Окислителем в данной реакции является MnO4-, а восстановителем – Br-. В окислительно-восстановительном процессе участвуют 10 электронов. Отсюда:
lgK = 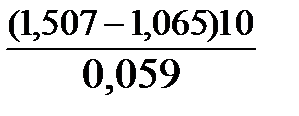 = 76,27,
= 76,27,
K =1,86.1076.
ПРИМЕР 4. Рассчитайте равновесный потенциал электрода, на котором протекает реакция PbO2+ 4 H+ + 2ē ↔ Pb2+ + 2H2О, если 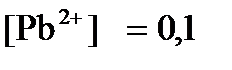 моль/л, а рН=5.
моль/л, а рН=5.
РЕШЕНИЕ. Потенциал окислительно-восстановительного электрода определяем по уравнению:
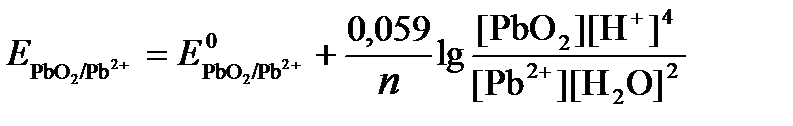 .
.
Концентрация 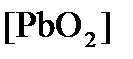 (как твердого вещества) и
(как твердого вещества) и 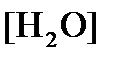 принимаются постоянными и включены в
принимаются постоянными и включены в 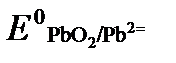 =+1,449 В, n=2 –число электронов. С учетом этого,
=+1,449 В, n=2 –число электронов. С учетом этого,
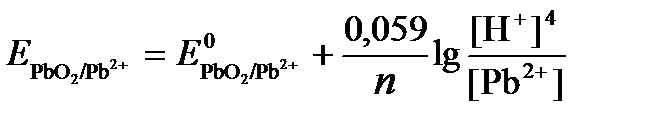
Исходя из того, что рН =-lg[H+] или [H+]= 10-рН , данное уравнение принимает вид:
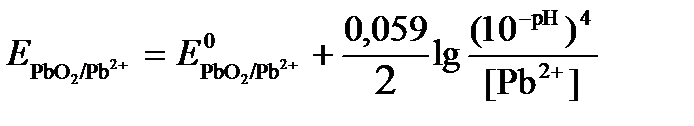
Подставляя значения Е0 и концентраций ионов, получаем
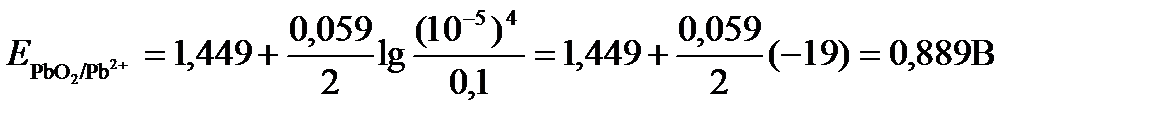
ПРИМЕР 5. Рассчитайте ЭДС окислительно-восстановительной системы
3Fe2+ + NO3- + 4H+ = NO + 3Fe3+ + 2H2O,
если [Fe2+]=10-3 моль/л, [Fe3+]=10-2 моль/л, [NO3-]=10-1 моль/л, а рН=3.
РЕШЕНИЕ. Выразим данную ОВ-систему в виде окислительно-восстановительных полурекций с указанием стандартных ОВ-потенциалов:
а) Fe2+ - ē →Fe3+ 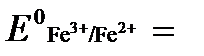 +0,771 В,
+0,771 В,
б) NO3- + 4H+ + 3ē → NO + 2H2O 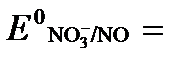 +0,960 В.
+0,960 В.
Для реакции (а) определим ОВ-потенциал по уравнению (3):
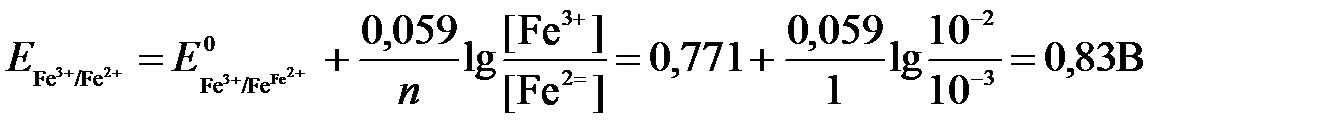
Для реакции (б) используем уравнение Нернста с учетом рН-среды:
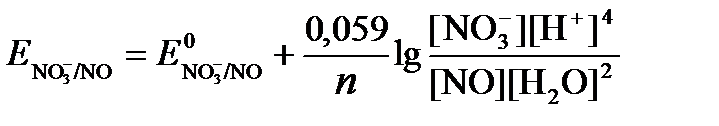 .
.
Имея ввиду, что активности [NO] и [H2O] являются постоянными и включены в значение Е0, а [H+]=10-рН,рассчитаем ОВ-потенциал реакции (б) по уравнению:
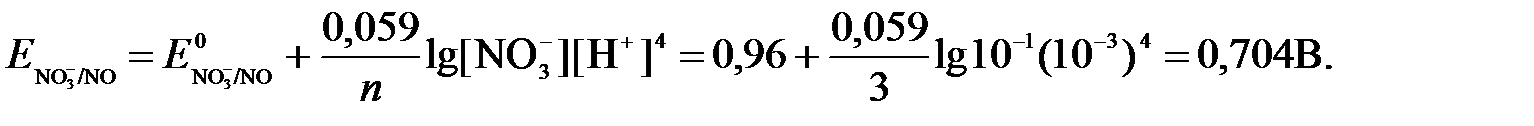
Затем рассчитаем ЭДС приведенной окислительно-восстановительной системы:
ЭДС= ΔЕ =Еокс – Евосст= 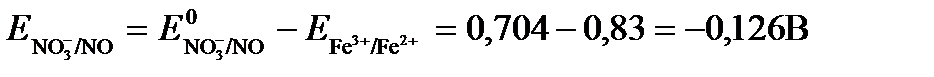
Так как ΔЕ <0, следовательно, реакция в прямом направлении протекать не может.
ПРИМЕР 6.Могут ли в стандартных условиях KClO3 и КBr одновременно находиться в щелочном растворе? Если нет, то укажите возможные продукты окисления и восстановления.
РЕШЕНИЕ. В бромиде калия КBr бром имеет низшую степень окисления -1 (Br-1), следовательно, он может проявлять только восстановительные свойства. В щелочной среде возможны следующие реакции окисления Br-1:
а) Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О Е0 = +0,61В
б) Br-1 + 2ОН- - 2ē = BrО-1 + Н2О Е0 = +0,76В.
В ионе ClO3- хлор находится в промежуточной степени окисления +5. В случае совместного нахождения в растворе с восстановителем (КBr), KClO3 будет проявлять только окислительные свойства.
В щелочном растворе возможно восстановления ClO3- по реакции:
ClO3- + 3Н2О +6е = Cl- + 6ОН- Е0 = +0,63В.
Сравнивая потенциалы окислителя и восстановителя, можно сделать вывод, что реакция окисления Br-1 по реакции (б) не может протекать, потому что Еок < Eвосс. Окисление же Br-1 в присутствии KClO3 по реакция (а) возможно:
Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О
+
ClO3- + 3Н2О +6ē = Cl- + 6ОН-
Br-1 + 6ОН- + ClO3- + 3Н2О = BrО3-1 + 3Н2О + Cl- + 6ОН-
KClO3 + КBr = КBrО3+ КCl
Таким образом, KClO3 и КBr одновременно находиться в щелочном растворе не могут, а вероятные продукты реакции - KCl и К BrО3.
ПРИМЕР 7. Может ли пероксид водорода H2O2 проявлять окислительные и восстановительные свойства? На основании стандартных электродных потенциалов привести примеры возможных реакций.
РЕШЕНИЕ. Пероксид водорода H2O2 имеет в своем составе кислород в промежуточной степени окисления (-1), поэтому он может проявлять как окислительные, так и восстановительные свойства.
Например, в кислой среде восстановление H2O2 протекает по реакции:
H2O2 + 2H+ + 2ē = 2H2O E0 =1,776 B.
Окисление H2O2 протекает по реакции:
H2O2 -2ē = О2 + 2Н+ E0 =0,682 B.
Чтобы в ОВ-реакции H2O2 проявлял окислительные свойства, надо по окислительно-восстановительным потенциалам выбрать восстановитель, у которого потенциал был меньше 1,776 В. Например, ион I- для которого:
2 I-1 - 2ē = I2 Е0 = +0,536В.
Таким образом:
H2O2 + 2H+ + 2ē = 2H2O
2 I-1 - 2ē = I2
H2O2 + 2H+ + 2 I-1 = I2 + 2H2O.
Чтобы в ОВ-реакции H2O2 проявлял восстановительные свойства, надо по окислительно-восстановительным потенциалам выбрать окислитель, у которого потенциал был больше 0,682 В. Например, ион ClO3- для которого:
2ClO3- + 12H+ + 10е = Cl2 + 6 H2O Е0 = +1,47В.
Таким образом:
H2O2 -2ē = О2 + 2Н+ 5
2ClO3- + 12H+ + 10ē = Cl2 + 6 H2O
5H2O2 -2ClO3- + 12H+ = 5О2 + 10Н+ + Cl2 + 6 H2O.
Сократив в правой части ионы водорода (Н+), получаем:
5H2O2 -2ClO3- + 2H+ = 5О2 + Cl2 + 6 H2O.
ПРИМЕР 8. Какой из металлов никель или кадмий легче взаимодействует с разбавленной HCl?
РЕШЕНИЕ. Запишим уравнения реакции взаимодействия этих металлов с HCl:
а) Ni + 2 HCl → NiCl2 + H2
Ni – 2ē = Ni2+ E0 = -0,25 B
2Н+ + 2ē =Н2 Е0 = 0,0В
б) Cd + 2 HCl → CdCl2 + H2
Cd – 2ē = Cd 2+ E0 = -0,403 B
2Н+ + 2ē =Н2 Е0 = 0,0В
Рассчитаем для обеих реакций изменение свободной энергии Гиббса по формуле
ΔGх.р.0= -nF (Е0окс – Е0восст).
Для реакции (а) ΔGх.р. = -2.96500.(0,0 + 0,25)= -48250 Дж.
Для реакции (б) ΔGх.р. = -2.96500.(0,0 + 0,403)= -77779 Дж.
Так как в реакции (б) убыль свободной энергии Гиббса больше, чем в реакции (а), следовательно, кадмий легче взаимодействует с HCl.
ПРИМЕР 9. На основании окислительно-восстановительных потенциалов реакций восстановления иона ClО3- определите, в какой среде, нейтральной или кислой, ClО3- проявляет более сильные окислительные свойства.
РЕШЕНИЕ. Представим возможные реакции восстановления иона ClО3- в нейтральной и кислой средах:
C1О3- + 3H2O + 6ē = Cl- + 6ОH- E0 =0,63 B
2C1О3- + 12H+ +10ē = Cl2 + 6Н2О E0 =1,47 B
Процесс протекает тем глубже, чем отрицательнее ΔGхр. Из соотношения ΔG0х.р = -nF(Е0ок – E0восс ) следует: чем выше потенциал окислителя, тем меньше ΔG0хр. В кислой среде ОВ-потенциал иона ClО3- больше, значит, в кислой среде он проявляет более сильные окислительные свойства.
Задания
1. Можно ли при стандартных условиях восстановить ионы Fe3+ ионами таллия Tl+ по реакции
2Fe3+ + Tl+ = 2Fe2+ + Tl3+ ?
2. Могут ли при стандартных условиях находиться одновременно в растворе селенистая кислота H2SeO3 и йодистоводородная HI ?
3. Какие из приведенных реакций могут самопроизвольно протекать в нейтральном водном растворе?
а) MnO4- + Cl-→ MnO2 + Cl2;
б) MnO4- + Br-→ MnO2 + Br2;
в) MnO4- + I- → MnO2 + I2.
4. Можно ли при стандартных условиях окислить хлором сульфат железа (II) в сульфат железа (III)?
5. Можно ли металлическим цинком восстановить хлорид железа (III) в хлорид железа (II)?
6. Сопоставьте устойчивость растворов гидроксидов железа (II) и кобальта (II) к окислению кислородом воздуха по реакциям:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
4Co(OH)2 + O2 + 2H2O = 4Co(OH)3
7. Может ли при стандартных условиях идти реакция
2Fe2+ + 2Hg2+ = 2Fe3+ + Hg22+?
8. Определите возможность самопроизвольного протекания реакции при стандартных условиях
2KMnO4 + 16HF = 2MnF2 + 5F2 + 2KF + 8H2O
9. Определите возможность самопроизвольного протекания реакции при стандартных условиях
2KMnO4 + 16HBr = 2MnBr2 + 5Br2 + 2KBr + 8H2O
10. Определите возможность самопроизвольного протекания реакции при стандартных условиях
2FeO42- + 8H+ + 2Br- → Fe3+ + Br2 + 4H2O
11. Определите возможность самопроизвольного протекания реакции при стандартных условиях
AsO43- + 2H2O + 2I- = AsO2- + I2 + 4OH-
12. Вычислите константу равновесия реакции
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
13. Определите направление реакции при стандартных условиях
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 2S + K2SO4 + 8H2O
14. Какие из приведенных ниже систем
Co3+ + ē = Co2+;
Pb4+ + 2ē = Pb2+;
I2 + 2ē = 2I-
будут восстановителем, если в качестве окислителя использовать кислый
раствор KMnO4 (pH=1) MnO4- + 8H+ + 5ē = Mn2+ + 4H2O
15. Может ли KNO2 быть восстановителем? окислителем? Используя
таблицу значений стандартных окислительно-восстановительных
потенциалов, приведите схемы возможных реакций.
16. Можно ли в стандартных условиях окислить ионы двухвалентного железа (Fe2+) ионами Sn4+ по схеме
2Fe2+ + Sn4+→ 2Fe3+ + Sn2+
17. Вычислите константу равновесия реакции
H3AsO4 + 2HI = HAsO2 + I2 + 2H2O.
Можно ли считать это равновесие практически полностью смещенным
вправо?
18. Какой из металлов (цинк, марганец или хром) легче взаимодействует
с разбавленной HCl ? Ответ дайте на основании расчета.
19. Определите направление процессов при стандартных условиях.
I2 + H2O = HIO3 + HI,
I2 + KOH = KIO3 + KI + H2O.
20. В водном растворе концентрация [Hg2+]=10-2 моль/л, [(Fe3+]=10-2 моль/л,
[Fe2+]=10-3 моль/л. В каком направлении реакция
2FeCl3 + Hg = 2FeCl2 + HgCl2
протекает самопроизвольно?
21. Можно ли восстановить хлорид олова (IV) в хлорид олова (II) по реакциям
SnCl4 + 2KI = SnCl2 + I2 + 2KCl
SnCl4 + H2S = SnCl2 + S + 2HCl
Обоснуйте ответ расчетом констант равновесия реакций.
22. Рассчитайте при стандартных условиях константу равновесия реакции
2KMnO4 + 5HBr + 3H2SO4 = 2MnSO4 + 5HBrO + K2SO4 + 3H2O.
23. Пользуясь величинами E0, определите направление реакции
Cu2+ + 2Ag = Cu + 2Ag+
24. Растворение цинка в разбавленной азотной кислоте может идти так:
а) Zn + HNO3→ Zn(NO3)2 + NO + H2O
б) Zn + HNO3→ Zn(NO3)2 + NO2 + H2O
Пользуясь величинами Е0 указать, какой процесс более выгоден в стандартных условиях?
25. Приведите пример окислительно-восстановительной реакции, потенциал которой зависит от pH среды, напишите уравнение для расчета окислительно-восстановительного потенциала для этой реакции.
26. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F- - 2ē = F2 б) 2Cl- - 2ē = Cl2
в) 2Br- - 2ē = Br2 г) 2I- - 2ē = I2
Стандартный окислительно-восстановительный потенциал системы
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O равен 1,33 В.
27. Можно ли KMnO4 использовать в качестве окислителя в следующих процессах при стандартных условиях:
а) HNO2 + H2O – 2ē = NO3- + 3H+
б) 2H2O – 2ē = H2O2 + 2H+
в) H2S – 2ē = S + 2H+
28. В каком направлении будет протекать реакция
CrCl3 + Br2 + KOH = K2CrO4 + KBr + H2O ?
29. Возможна ли реакция между KClO3 и КmnO4 в кислой среде?
30. Какой из окислителей(MnO2, PbO2, K2Cr2O7) является наиболее эффективным по отношению к HCl с целью получения Cl2?
31. Можно ли при стандартных условиях окислить в кислой среде Fe2+ в Fe3+ с помощью дихромата калия (K2Cr2O7)?
32. Можно ли действием хлората (V) калия (KClO3) в нейтральной среде окислить:
а) Fe2+ до Fe3+
б) SO42- до S2O82-
в) Mn2+ до MnO4-
г) Sn2+ до Sn4+
д) SO32- до SO42-
е) NO2- до NO3-
Напишите уравнения окислительно-восстановительных реакций.
33. Окислительно-восстановительный потенциал реакции
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O
равен +1,33 В. Какие из следующих процессов возможны, если в качестве окислителя использовать кислый раствор дихромата калия (K2Cr2O7)?
а) 2Br- - 2ē = Br2
б) 2Cl- - 2ē = Cl2
в) H2S – 2ē = 2H+ + S
г) Mn2+ + 4H2O – 5ē = MnO4- + 8H+
д) HNO2 + H2O – 2ē = NO3- + 3H+
34. Будет ли протекать реакция, в которой Cr3+ окисляется до Cr2O72-, а разбавленная HNO3 восстанавливается до NO?
35. При окислении соляной кислоты диоксидом марганца или перманганатом калия образуется хлор. Процессы идут по схеме:
MnO2 + HCl → MnCl2 + Cl2 + H2O
KMnO4 + HCl→ MnCl2 + Cl2 + KCl + H2O
В каком случае получится больше хлора, если для той и другой реакции взять равные количества соляной кислоты?
36. На основании значений окислительно-восстановительных потенциалов процессов восстановления перманганата-иона MnO4- в кислой, нейтральной и щелочной средах укажите: в каком случае ион MnO4- проявляет более высокую окислительную способность.
37. В каком направлении будет протекать реакция
CuS + H2O2 + HCl = CuCl2 + S + H2O?
38. Можно ли при стандартных условиях окислить хлористый водород до Cl2 с помощью серной кислоты?
39. Вычислите окислительно-восстановительный потенциал для системы
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O,
если [MnO4-]=10-5, [Mn2+]=10-2, [H+]=0,1 моль/л.
40. Рассчитайте ЭДС окислительно-восстановительной системы
6Fe2+ + ClO3- + 6H+ = Cl- + 6Fe3+ + 3H2O,
если pH = 3, а концентрация ионов Fe2+, ClO3-, Cl- и Fe3+ соответственно равны моль/л: 10-2; 10-1; 1,0; 2,0.
41.Вычислите при стандартных условиях ЭДС окислительно-восстановительной системы, состоящей из электродов: S/H2S и NO3-/NO.
Напишите уравнение протекающей реакции.
42. В подкисленный раствор смеси KCl, KBr и KIприбавлен раствор
KMnO4. Какие галогенид-ионы могут быть окислены до свободного состояния действием перманганат-иона? Составить уравнения протекающих реакций.
43. В водном растворе концентрация [Hg2+]=0,01 моль/л, [Fe3+]=0,01 моль/л, [Fe2+]=0,001 моль/л. Какая из указанных реакций будет протекать:
а) 2FeCl3 + Hg = 2FeCl2 + HgCl2
б) HgCl2 + 2FeCl2 = Hg + 2FeCl3
44. Вычислите константы равновесия для реакций:
а) SnCl4 + 2TiCl3 = SnCl2 + 2TiCl4
б) SnCl4 + 2CrCl2 = SnCl2 + 2CrCl3
В какой из двух систем достигается более полное восстановление Sn4+ в Sn2+?
45. Какая кислота выполняет в реакции H2SeO3 + H2SO3 функцию окислителя, а какая – восстановителя ?
46. Методом ионно-электронных уравнений подберите коэффициенты в следующих окислительно-восстановительных реакциях. Укажите окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
1) Al + K2Cr2O7 + H2SO4→ Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
2) Al + KMnO4 + H2SO4→ Al2(SO4)3 + MnSO4 + K2SO4 + H2O
3) MnO2 + KClO3 + KOH→ K2MnO4 + KCl + H2O
4) Bi2O3 + Br2 + KOH→ KBiO3 + KBr + H2O
5) SnCl2 + K2Cr2O7 + HCl → SnCl4 + CrCl3 + KCl + H2O
6) MgI2 + H2O2 + H2SO4→ I2 + MgSO4 + H2O
7) FeSO4 + KClO3 + H2SO4→Fe2(SO4)3 + KCl + H2O
8) KNO2 + K2Cr2O7 + H2SO4→ KNO3 + Cr2(SO4)3 + K2SO4 + H2O
9) MnO2 + O2 + KOH→ K2MnO4 + H2O
10) SO2 + FeCl3 + H2O→ H2SO4 + FeCl2 + HCl
11) H2S + K2Cr2O7 + H2SO4→ S + Cr2(SO4)3 + K2SO4 + H2O
12) H2SO3 + HIO3→ H2SO4 + HI
13) Zn + KMnO4 + H2SO4→ ZnSO4 + MnSO4 + K2SO4 + H2O
14) KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
15) SO2 + KMnO4 + H2O → K2SO4 + MnO2 + H2SO4
16) KI + KMnO4 + KOH → I2 + K2MnO4 + H2O
17) MnO2 + H2SO4→ MnSO4 + O2 + H2O
18) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
19) KNO2 + KMnO4 + KOH → KNO3 + K2MnO4 + H2O
20) K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O
21) NaCrO2 + H2O2 + NaOH→ Na2CrO4 + H2O
22) P + HNO3 + H2O → H3PO4 + NO
23) KMnO4 + H2S + H2SO4 → S + MnSO4 + K2SO4 + H2O
24) Fe2O3 + KNO3 + KOH→ K2FeO4 + KNO2 + H2O
25) I2 + KOH → KI + KIO3 + H2O
26) KIO3 + H2O2 + H2SO4→ O2 + I2 + K2SO4 + H2O
27) Al2 + KOH + H2O →K[Al(OH)4] + H2
28) SnCl2 +KMnO4 + HCl → SnCl4 + MnCl2 +H2O
29) Cl2 + KI + KOH → KCl + KIO3 + H2O
30) SnCl2 +FeCl3 → SnCl4 + FeCl2
47. Методом электронно-ионных уравненийсоставьте полные уравнения реакций, учитывая, что либо окислитель, либо восстановитель являются также и средой. Обоснуйте на основании стандартных окислительно-восстановительных потенциалов возможность протекания данных реакций.
1) KI + H2SO4/конц/→ I2 + H2S + K2SO4 + H2O
2) KBr + H2SO4/конц/→ Br2 + S + K2SO4 + H2O
3) NaBr + H2SO4/конц/→ Br2 + SO2 + Na2SO4 + H2O
4) Mg + H2SO4/конц/→ MgSO4 + S + H2O
5) Al + H2SO4/конц/→ Al2(SO4)3 + H2S + H2O
6) Cu + H2SO4/конц/→ CuSO4 + SO2 + H2O
7) Ag + H2SO4/конц/→ Ag2SO4 + SO2 + H2O
8) HCl/конц/ + MnO2→ Cl2 + MnCl2 + H2O
9) HCl/конц/ + KMnO4→Cl2 + MnCl2 + KCl + H2O
10) HCl/конц/ + PbO2→ Cl2 + PbCl2 + H2O
11) HCl/конц/ + CrO3 → Cl2 + CrCl3 + H2O
12) HCl/конц/ + K2Cr2O7→ Cl2 + CrCl3 + KCl + H2O
13) Zn + H2SO4/конц/ → ZnSO4 + H2S + H2O
14) CuS + HNO3→ S + Cu(NO3)2 + NO + H2O
15) Cu2O + HNO3→ Cu(NO3)2 + NO + H2O
16) CuS + HNO3/конц/→ H2SO4 + Cu(NO3)2 + NO2 + H2O
17) FeS + HNO3/конц/→ Fe(NO3)2 + H2SO4 + NO2 + H2O
18) MnS + HNO3→ S + NO + Mn(NO3)2 + H2O
19) FeSO4 + HNO3→ Fe2(SO4)3 + Fe(NO3)3 + NO2 + H2O
20) MnS + HNO3/конц/→H2SO4 + NO2 + Mn(NO3)2 + H2O
21) Ag + HNO3/конц/→ AgNO3 + NO2 + H2O
22) Zn + HNO3→ Zn(NO3)2 + NO + H2O
23) Mg + HNO3/очень разб./→ Mg(NO3)2 + NH4NO3 + H2O
24) Fe + HNO3→ Fe(NO3)3 + NO + H2O
25) S + HNO3→ H2SO4 + NO
26) H2S + HNO3→ S + NO2 + H2O
27) Cu + HNO3/разб/→ Cu(NO3)2 + NO + H2O
28) Sn + HNO3/конц/→ H2SnO3 + NO2 + H2O
29) Fe + H2SO4/конц/→ Fe2(SO4)3 + SO2 + H2O
30) K2S + HNO3→ S + NO + KNO3 +H2O
48. Окислительно- восстановительная реакция выражается ионным уравнением. Укажите, какой ион является окислителем, какой – восстановителем. Составьте ионно-электронные и молекулярные уравнения.
1). Bi + NO3– + H+ → Bi +3 + NO + H2O
2) Fe+2 + ClO3– + H+ → Fe+3 + Cl– + H2O
3) Cr+3 + BiO3– + H+ → Bi +3+ Cr2O72- + H2O
4) SO2 + Cr2O72- + H+ → Cr+3 + SO42-+ H2O
5) Cl– + MnO4–+ H+ → Cl2 + Mn+2 + H2O
6) H2O2 + MnO4–+ H+ → O2 + Mn+2 + H2O
7) I– + NO2– + H+ → I2 + NO + H2O
8) Br–+ Cr2O72- + H+ → Cr+3+ Br2+ H2O
9) I– + H2O2 + H+ → I2 + H2O
10) Cl2 + OH– → Cl– + ClO3–+ H2O
11) H2S + MnO4–+ H+ → S + Mn+2 + H2O
12) Cl– + MnO2 + H+ → Cl2 + Mn+2 + H2O
13) Mg + NO3– + H+ → Mg +2 + NH4+ + H2O
14) ClO3–+ SO32- + + H+ → Cl–+ SO42- + H2O
15) NO2– + MnO4–+ H+ → NO3– + Mn+2 + H2O
16) Br2 + OH– → Br– + BrO3–+ H2O
17) Sn+2 + BrO3– + H+ → Br2+ Sn+4+ H2O
18) Cu + NO3– + H+ → Cu +2 + NO2 + H2O
19) Cr2O72- + H+ + Fe+2 → Cr+3+ Fe+3 + H2O
20) Br– + MnO4–+ H+ → Br2 + Mn+2 + H2O
21) Pb + + NO3– + H+ → Pb +2 + NO + H2O
22) Mn+2 + ClO3–+ OH– → MnO42–+ Cl–+ H2O
23) Bi + NO3– + H+ → Bi3+ + NO + H2O
24) Cr2O72– + I– + H+ → Cr3+ + I2 + H2O
25) CrO2- + Br2 + OH-→ CrO4 2– Br- + H2O
26) SO32– + Ag+ + OH– → SO42– + Ag + H2O
27) Fe2+ + MnO4– + H+ → Fe3+ + Mn2+ + H2O
28) MnO4– + I– + H+ → I2 + Mn2+ + H2O
29) MnO4– + SO3- + H2O → MnO2 + SO42- + OH-
30) MnO4– + OH– +SO32– → SO42– + MnO42– + H2O
ЛАБОРАТОРНАЯ РАБОТА
