Ознакомиться со схемой лабораторной диагностики брюшного тифа и паратифов
Возбудителями брюшного тифа и паратифов (А, В) являются бактерии рода Salmonella, в состав которого входят два вида: Salmonella enterica с 6 подвидами (включая возбудители брюшного тифа, паратифов, сальмонеллезов – всего более 2400 сероваров) и Salmonellabongori(редко встречающиеся сальмонеллы).Возбудитель брюшного тифа обозначается как Salmonellaсеровара Typhi (Salmonella entericaspp. enterica ser. typhi, прежнее название Salmonella typhi), паратифа А — Salmonellaсеровара ParatyphiA, паратифа В — Salmonellaсеровара Paratyphi В.
Методы микробиологической диагностики брюшного тифа и паратифов представлены в схеме 9.
Выбор материала и метода микробиологической диагностики этих заболеваний зависит от стадии патогенеза. На первой неделе заболевания и в течение всего лихорадочного периода возбудитель можно выделить из крови (гемокультура), с конца второй и на третьей неделе — из мочи (уринокультура) и испражнений (копрокультура). Высокий процент высеваемости возбудителя отмечается при исследовании костного мозга (выделение миелокультуры). Удается обнаружить сальмонеллы в скарификате розеол (розеоло-культура), ликворе, содержимом двенадцатиперстной кишки, секционном материале. У реконвалесцентов исследуют испражнения и желчь (выделение биликультуры). Начиная со второй недели заболевания проводят серологическое исследование. Микроскопическое исследование материала от больного не проводится, т.к. все энтеробактерии (как патогенные, так и непатогенные, например, E.coli) по морфологическим свойствам идентичны (рис. 14).
Бактериологическое исследованиеявляется основным лабораторным методом диагностики брюшного тифа и паратифов.
Ранним и надежным методом бактериологической диагностики является выделение возбудителей из крови (гемокультура).Взятую в асептических условиях кровь (15-20 мл) засевают на 10% желчный бульон или среду Рапопорт (10% желчный бульон, 1 % маннита или 2 % глюкозы, 1 % индикатора Андреде; в среду помещен поплавок для улавливания газа) в соотношении крови и среды 1:10 для накопления сальмонелл. Посевы инкубируют при 370 С 18 —24 ч. При наличии сальмонелл маннит или глюкоза расщепляется с образованием кислоты и среда приобретает красный цвет; появление в поплавке газа свидетельствует о газообразовании - характерном признаке паратифозных бактерий.
Схема 9.Микробиологическая диагностика брюшного тифа и паратифов.



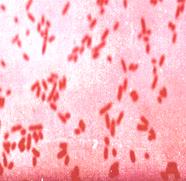
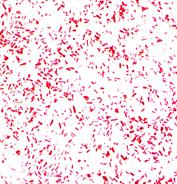
А б
Рис. 14. а - кишечная палочка(E.coli ув. Х1350), б- возбудитель брюшного тифа(S.typhi, ув. Х630) в мазках из чистой культуры. Окраска по Граму. Грамотрицательные беспорядочно расположенные палочки средних размеров.
Копрокультуру выделяют путем посева фекалий на среду Плоскирева, Эндо, висмут-сульфит агар и среды накопления (селенитовую, магниевую, тетратионатную, Кауфмана, Мюллера) с последующей 18 —24-часовой инкубацией при 37 °С.
На 2-й день на средах Плоскирева, МакКонки или Эндо вырастают бесцветные (лактозоотрицательные) колонии, а на висмут-сульфит-агаре – черные. Колонии сальмонелл паратифа А окрашены взеленый цвет, так как не образуют сероводород. Из типичных колоний готовят мазок, окрашивают по Граму и после микроскопии остаток колонии пересевают на среду Ресселя или Олькеницкого. При отсутствии типичных колоний на те же среды засевают материал со среды обогащения.
На 3-й день исследования учитывают характер роста на среде Ресселя или Олькеницкого (окрашивание столбика среды Ресселя в синий цвет, среды Олькеницкого в желтый в результате ферментации глюкозы в анаэробных условиях; скошенная часть среды не изменена – отсутствие ферментации лактозы), готовят мазок для проверки чистоты выделенной культуры, выполняют пересев в среды «пестрого» ряда для изучения биохимических свойств (см. табл. 10), после чего
ставят ориентировочную, а потом развернутую РА. Ориентировочную РА ставят со смесью О-сывороток, включающей агглютинины к О-антигенам 2, 4, 7, 8, 9, 3-10. При отсутствии РА с этой смесью используют смесь монорецепторных О-сывороток к редким группам сальмонелл (антитела к антигенам 11, 13, 15, 19, 23 и т.д.) При получении положительных результатов культуру испытывают отдельно с каждой из О-сывороток, входящих в состав смеси. После этого культуру агглютинируют с Н-сыворотками 1 фазы (a, b, i, c, d, g, m) а потом 2 фазы (1,2; 1,5), устанавливая антигенную формулу выделенной сальмонеллы в соответствии со схемой Кауфмана-Уайта (таблица 9). Эта схема разработана на основании изучения у сальмонелл О и Н антигенов и применяется с целью антигенной идентификации патогенных сальмонелл.
Таблица 9. Антигенная структура сальмонелл (сокращенная схема Кауфмана-Уайта)
| Группа | Серовар | О-антиген | Н-антиген | |
| Фаза 1 | Фаза 2 | |||
| А | Paratyphi A | 1, 2, 12 | a | - |
| B | Paratyphi B Typhi murium | 1, 4, 5, 12 1, 4, 5, 12 | b i | 1, 2 1, 2 |
| C | Paratyphi C Cholerae suis | 6, 7, Vi 6, 7 | c c | 1, 5 1, 5 |
| D | Typhi Enteritidis | 9, 12, Vi 1, 9, 12. | d g, m | - - |
На 4-й день от начала исследования учитывают изменения сред «пестрого» ряда (см. табл. 10), результаты развернутой РА и выдают ответ. Выделенные культуры подвергают фаготипированию, что позволяет установить источник и пути заражения.
Мочу, дуоденальное содержимое, соскоб розеол, секционный материал с целью выделения тифо-паратифозных бактерий засевают на плотные среды (Эндо, Мак-Конки и т.п. в чашке Петри), а также в среды накопления. При наличии характерного роста идентификация проводится по вышеописанной схеме.
Таблица 10. Биохимические свойства возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Продукция | ||||||
| Лакто- Зы | Глю- козы | Маль- тозы | Саха- розы | Ман- нита | Н2S | NH3 | индо- ла | |
| Typhi | - | К | К | - | К | + | - | - |
| Paratyphi A | - | КГ | КГ | - | КГ | - | - | - |
| Paratyphi В | - | КГ | КГ | - | КГ | + | + | - |
Обозначения: (+) - наличие свойства, (-) - отсутствие свойства, К – образование кислоты, КГ – образование кислоты и газа.
Аналогично проводится исследование испражнений упереболевших брюшным тифом и паратифом лиц, а также у работников детских учреждений, питания и водоснабжения с целью выявления бактерионосителей.
Серологическое исследование.Для серологической диагностики брюшного тифа и паратифов ставят реакцию Видаля (развернутая РА) с целью определения соответствующих антител в крови больного. Антитела к возбудителям брюшного тифа, паратифов А и В обнаруживаются в сыворотке крови больных с 8— 10-го дня заболевания. Исследуемую сыворотку крови разводят двукратно в 6 параллельных рядах пробирок от 1:100 до 1: 1600 в объеме 1 мл, куда вносят по 2 капли ОН- и О- брюшнотифозного, паратифозного Аи паратифозного В диагностикумов. О-диагностикумы получают кипячением или обработкой спиртом взвеси соответствующих культур, ОН-диагностикумы - обработкой формалином. Для контроля антигена диагностикумы вносятся в той же дозе в 1 мл физиологического раствора, а для контроля сыворотки используют сыворотку в разведении 1:100 без добавления диагностикумов.
О-антитела имеют диагностическое значение, они появляются в крови на второй неделе заболевания и исчезают к его концу, а Н-агглютинины нарастают к концу заболевания. и диагностической ценности не имеют. Н-антитела могут обнаруживаться также у переболевших и вакцинированных. Ряд брюшнотифозных вакцин вызывает также выработку Vi – и О антител. Диагностический титр О-антител в реакции Видаля у неиммунизированных лиц 1 :100, а при отсутствии типичной клинической картины - 1 :200. Однако титр антител у больных может быть ниже диагностического в связи с ранним назначением антибиотиков или наличием у больного вторичного иммунодефицита. Таким образом, отрицательная реакция Видаля не исключает тифопаратифозное заболевание. С другой стороны, повышенные титры О-антител могут быть обусловлены прививками. Поэтому при подозрении на брюшной тиф или паратифы целесообразно исследовать сыворотку крови как можно раньше (до появления антител), а затем в динамике (с интервалом 7-12 дней) для выявления нарастания титра антител более чем в 4 раза. Если сыворотка крови больного агглютинирует одновременно два или три вида диагностикумов, учитывают титр агглютинации: специфическая агглютинация происходит обычно с более высокими, а групповая — с более низкими разведениями сыворотки.
Более чувствительны РНГА с эритроцитарными групповыми (А, В, С, Д, Е)и монорецепторными диагностикумами, а также ИФА, которые ставят с парными сыворотками в динамике заболевания.
Vi-антитела чаще обнаруживаются у бактерионосителей сальмонелл брюшного тифа, т.к. Vi-антиген способствует длительной персистенции возбудителя в организме. При обследовании лиц, подозрительных на носительство брюшнотифозных палочек, применяется РНГА с эритроцитарным Vi-диагностикумом для определения соответствующих антител и их принадлежности к классу IgG.
