В) методические разработки. 9. Введение в неорганическую химию: учебное пособие для студентов фармацевтических
9. Введение в неорганическую химию: учебное пособие для студентов фармацевтических вузов и факультетов/ В.А. Компанцев [и др.]. – Пятигорск: Пятигорская ГФА, 2009. – С. 63-82.
Тема. Окислительно-восстановительные реакции. Метод полуреакций.
УИРС: Окислительно-восстановительные процессы, определение возможности самопроизвольного осуществления химической реакции.
Вопросы для самостоятельной внеаудиторной подготовки
к занятию:
1. Какие реакции называются окислительно-восстановительными?
2. Электронная теория окислительно-восстановительных реакций.
3. Типы окислительно-восстановительных реакций.
4. Что называется стандартным ОВ-потенциалом системы? Как определяют направление ОВ-реакции по значению ОВ-потенциалов?
5. Какая существует взаимосвязь между DGo и DEo (ЭДС) ОВ-реакции при стандартных условиях (какой формулой эта взаимосвязь выражается)?
Изучив эти вопросы, выполните письменно следующие
задания:
Вариант № 1
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) KIO3 + Na2SO3 + H2SO4 ® I2 + Na2SO4 + К2SO4 + H2O
2) MnSO4 + KIO4 + H2O ® HMnO4 + KIO3 + H2SO4
3) As2O3 + I2 + KOH ® KI + K3AsO4 + H2O
4) MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
Вариант № 2
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) H2O2 + KMnO4 ® O2 + MnO2 + KOH + H2O
2) MnCl2 + KBrO3 + KOH ® MnO2 + KBr + KCl + H2O
3) Cu + HNO3(конц.) ® Cu(NO3)2 + NO2 + H2O
4) K2S + K2Cr2O7 + H2O ® Cr(OH)3 + S + KOH
Вариант № 3
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O
2) NO2 + O2 + NaOH ® NaNO3 + H2O
3) Cr2(SO4)3 + KMnO4 + H2O ® H2Cr2O7 + MnO2 + K2SO4 + H2SO4
4) Cl2 + KOH ® KCl + KClO + H2O
Вариант № 4
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) Zn + HNO3(разб.) ® Zn(NO3)2 + N2O + H2O
2) NaCrO2 + PbO2 + NaOH ® Na2CrO4 + Na2PbO2 + H2O
3) Al + NaOH + H2O ® Na[Al(OH)4] + H2
4) KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
Вариант № 5
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) Zn + NaOH + H2O ® Na2[Zn(OH)4] + H2
2) Cu + HNO3(разб.) ® Cu(NO3)2 + NO + H2O
3) SO2 + KMnO4 + H2O ® H2SO4 + K2SO4 + MnSO4 + H2O
4) Cr2O3 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
Вариант № 6
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) KMnO4 + KOH + SnCl2 ® K2MnO3 + K2SnO3 + КCl + H2O
2) SO2 + HNO3 + H2O ® H2SO4 + NO
3) KCr(SO4)2 + Br2 + KOH ® K2CrO4 + KBr + K2SO4 + H2O
4) AsH3 + AgNO3 + H2O ® H3AsO3 + Ag + HNO3
Вариант № 7
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
2) NO2 + NaOH ® NaNO2 + NaNO3 + H2O
3) H2S + HNO3 ® S + NO2 + H2O
4) Mg + H2SO4(конц.) ® MgSO4 + H2S + H2O
Вариант № 8
Составьте схемы электронного баланса. Расставьте коэффициенты, укажите окислитель и восстановитель, процессы восстановления и окисления:
1) KMnO4 + KBr + H2SO4 ® MnSO4 + Br2 + K2SO4 + H2O
2) S + KOH ® K2S + K2SO3 + H2O
3) KNO2 + KI + H2SO4 ® I2 + NO + K2SO4 + H2O
4) HIO3 + H2O2 ® I2 + O2 + H2O
Образец выполнения письменных заданий:
K2CrO4 + KBr + H2O ® Cr(OH)3 + Br2 + KOH
 ок-ль: Cr+6 + 3e- ® Cr+3 2 процесс восстановления в-ль: 2Br-1 – 2e- ® Br20 3 процесс окисления ок-ль: Cr+6 + 3e- ® Cr+3 2 процесс восстановления в-ль: 2Br-1 – 2e- ® Br20 3 процесс окисления |
2Cr+6 + 6Br-1 ® 2Cr+3 + 3Br20
2K2CrO4 + 6KBr + 8H2O ® 2Cr(OH)3 + 3Br2 + 10KOH
Литература для подготовки:
1. Лекция по теме занятия.
а) основная литература
2. Общая химия. Биофизическая химия. Химия биогенных элементов/
Ю.А. Ершов [и др.]. – М.: ВШ, 2002. – С. 131-141.
б) дополнительная литература
3. Пузаков, С.А. Химия: учебник /С.А. Пузаков – М.: ГЭОТАР – Медиа, 2006. – 640 с. – [Электронный ресурс]. – Режим доступа: www. pharma. studmeblid. ru.
4. Слесарев, В.И. Химия. Основы химии живого / В.И. Слесарев. – СПб.: Химиздат, 2001. – С. 208-215.
5. Химия: общая и неорганическая [Электронный ресурс] / сост. Ю.Я. Харитонов, Т.К. Слонская; ГОУ ВПО Моск. мед.акад. им. И.М. Сеченова; Фармац. фак.; Центр. науч. мед. б-ка. – Электрон.дан. – М.: Русский врач, 2004. – 1 электрон.опт. диск (СD- версия). – Загл. этикетки диска. – (Электрон.б-ка для высш. мед. и фармац. образования).
6. Глинка, Н.Л. Общая химия: учебник/ Н.Л. Глинка – М.: КНОРУС, 2010. –
С. 271-298.
7. Ахметов, Н.С. Общая и неорганическая химия: учебник / Н.С. Ахметов. –
6-е изд. стер. - М.: ВШ, 2005. –С. 234-244.
В) методические разработки
8. Введение в неорганическую химию: учебное пособие для студентов фармацевтических вузов и факультетов/ В.А. Компанцев [и др.]. – Пятигорск: Пятигорская ГФА, 2009. - С. 111-117.
Тема. Растворы, способы выражения состава растворов. УИРС: Приготовление растворов с заданным содержанием растворенного вещества.
Вопросы для самостоятельной внеаудиторной подготовки
к занятию:
1. Общие понятия: раствор, растворитель, растворенное вещество.
2. Растворимость. Назовите факторы, от которых зависит растворимость веществ.
3. Процесс растворения веществ. Из каких стадий состоит процесс растворения? Что называется тепловым эффектом растворения?
4. Какие растворы называются насыщенными, ненасыщенными и пересыщенными? Каковы условия их получения? Может ли быть насыщенный раствор разбавленным, а концентрированный – ненасыщенным? Приведите примеры.
5. Назовите известные вам способы выражения количественного состава растворов.
Изучив эти вопросы, выполните письменно следующие
задания:
Вариант № 1
1. К раствору массой 250 г с w(соли) = 10% добавили эту же соль массой 15 г. Рассчитайте массовую долю соли в полученном растворе.
Ответ: 15,09 %.
2. Смешали раствор массой 200 г с w(КОН) = 1% с раствором массой 50 г с w(КОН) = 4%. Вычислите массовую долю гидроксида калия в полученном растворе.
Ответ: 1,6%.
3. Рассчитайте объем воды, который необходимо добавить к раствору объемом 500 мл с w(NaOH) = 40% (r = 1,43 г/мл) для приготовления раствора с w(NaOH) = 10%.
Ответ: 2,15 л.
Вариант № 2
1. К раствору массой 300 г с w(ZnSO4) = 5% добавили сульфат цинка массой 20 г. Рассчитайте массовую долю ZnSO4 в полученном растворе.
Ответ: 10,94%.
2. Смешали раствор массой 150 г с w(КОН) = 5% с раствором массой 200 г с w(КОН) = 10%. Вычислите массовую долю щелочи в полученном растворе.
Ответ: 7,86%.
3. Рассчитайте объем воды, который необходимо добавить к раствору объемом 0,5 л с массовой долей серной кислоты 20% (r = 1,143 г/мл) для приготовления раствора с w(H2SO4) = 12%.
Ответ: 381 мл.
Вариант № 3
1. К раствору массой 450 г с w(NaCl) = 3% добавили эту же соль массой 25 г. Рассчитайте массовую долю NaCl в полученном растворе.
Ответ: 8,10%.
2. Смешали раствор массой 300 г с w(Na2SO4) = 2% с раствором массой 140 г с w(Na2SO4) = 6%. Вычислите массовую долю сульфата натрия в полученном растворе.
Ответ: 3,27%.
3. Рассчитайте объем воды, который необходимо добавить к раствору объемом 250 мл с w(HNO3) = 30% (r = 1,205 г/мл) для приготовления раствора с w(HNO3) = 25%.
Ответ: 60,25 мл.
Вариант № 4
1. К раствору массой 150 г с w(КОН) = 10% добавили гидроксид калия массой 5 г. Рассчитайте массовую долю КОН в полученном растворе.
Ответ: 12,9%.
2. Смешали раствор массой 60 г с w(NaNO3) = 2% с раствором массой 150 г с w(NaNO3) = 5%. Вычислите массовую долю нитрата натрия в полученном растворе.
Ответ: 4,14%.
3. Рассчитайте массу воды, которую нужно добавить к раствору массой 125 г с w(NaCl) = 8%, чтобы получить раствор с массовой долей этой соли 5%.
Ответ: 75 г.
Вариант № 5
1. Смешали раствор массой 300 г с w(NaCl) = 20% с раствором массой 500 г с w(NaCl) = 40%. Вычислите массовую долю хлорида натрия в полученном растворе.
Ответ: 32,5%.
2. Рассчитайте массу воды, которую надо добавить к раствору массой 20 г с w(Н2SO4) = 70% для получения раствора с w(Н2SO4) = 3%.
Ответ: 446,67 г.
3. Рассчитайте массу НCl, которая содержится в растворе объемом 120 мл с w(НCl) = 30% (r = 1,149 г/мл).
Ответ: 41,36 мл.
Вариант № 6
1. Рассчитайте массу воды, которую нужно добавить к раствору массой 40 г с w(H2SO4) = 20%, чтобы получить раствор с w(H2SO4) = 8%.
Ответ: 60 г.
2. Смешали раствор массой 300 г с w(КCl) = 10% с раствором массой 200 г с w(КCl) = 20%. Вычислите массовую долю хлорида калия в полученном растворе.
Ответ: 14%.
2. К раствору массой 500 г с w(CuSO4) = 4% добавили сульфат меди (II) массой 25 г. Рассчитайте массовую долю CuSO4 в полученном растворе.
Ответ: 8,57%.
Вариант № 7
1. Рассчитайте массу Na2SO3, необходимую для приготовления раствора объемом 5 л с w(Na2SO3) = 8% (r = 1,075 г/мл).
Ответ: 430 г.
2. К 250 г раствора с w(FeSO4) = 10% добавили воду объемом 150 мл. Рассчитайте массовую долю сульфата железа (II) в полученном растворе.
Ответ: 6,25%
3. Смешали раствор массой 120 г с w(КОН) = 9% с раствором массой 380 г с w(КОН) = 12%. Вычислите массовую долю гидроксида калия в полученном растворе.
Ответ: 11,28%.
Вариант № 8
1. Смешали раствор массой 250 г с w(NaОН) = 16% с раствором массой 200 г с w(NaОН) = 20%. Вычислите массовую долю гидроксида натрия в полученном растворе.
Ответ: 17,78%.
2. К 500 мл раствора с w(Н2SO4) = 32% (r = 1,2 г/мл) добавили воду объемом 1 л. Рассчитайте массовую долю серной кислоты в полученном растворе.
Ответ: 12%.
3. Рассчитайте массу НCl, которая содержится в растворе объемом 80 мл с w(НCl) = 5% (r = 1,023 г/мл).
Ответ: 4,09%.
Образец выполнения письменных заданий:
1. К раствору массой 540 г с w(КОН) = 20% добавили воду массой 110 г. Рассчитайте массовую долю гидроксида калия в полученном растворе.
Решение:
1) Рассчитаем массу КОН в растворах:
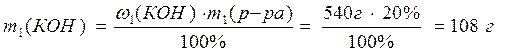
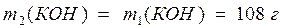
2) Найдем массу полученного раствора:
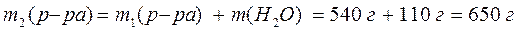
3) Рассчитаем массовую долю КОН в полученном растворе:
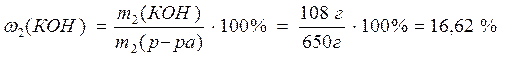
Ответ: 16,62%.
2. Смешали раствор массой 250 г с w(NaCl) = 12% с раствором массой 300 г с w(NaCl) = 8%. Вычислите массовую долю хлорида натрия в полученном растворе.
Решение:
1) Рассчитаем массу NaCl в растворе с массовой долей соли 12%:
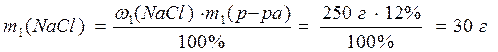
2) Найдем массу NaCl в растворе с массовой долей соли 8%:
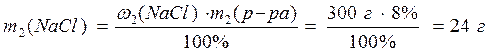
3) Рассчитаем массу полученного раствора:
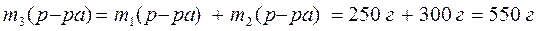
4) Найдем массу соли в полученном растворе:
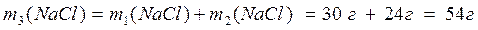
5) Рассчитаем массовую долю соли в полученном растворе:
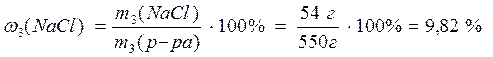
Ответ: 9,82%.
3. Рассчитайте объем воды, который необходимо добавить к раствору объемом 100 мл с w(HNO3) = 32% (r = 1,20 г/мл) для приготовления раствора с w(HNO3) = 12% .
Решение:
1) Рассчитаем массу раствора с массовой долей HNO3 32%:
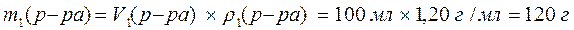
2) Найдем массу HNO3 в растворах:
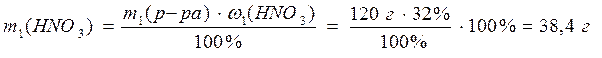
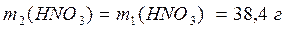
3) Рассчитаем массу раствора с массовой долей HNO3 12%:
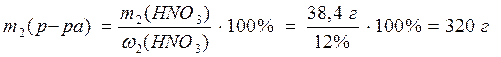
3) Найдем массу воды:
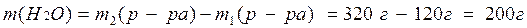
4) Рассчитаем объем воды, учитывая, что r(Н2О) = 1,0 г/мл:
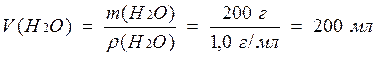
Ответ: 200 мл.
Литература для подготовки:
1. Лекция по теме занятия.
а) основная литература
2. Общая химия. Биофизическая химия. Химия биогенных элементов/
Ю.А. Ершов [и др.]. – М.: ВШ, 2002. – С. 42-79.
б) дополнительная литература
3. Пузаков, С.А. Химия: учебник /С.А. Пузаков – М.: ГЭОТАР – Медиа, 2006. – 640 с. – [Электронный ресурс]. – Режим доступа: www. pharma. studmeblid. ru.
4. Слесарев, В.И. Химия. Основы химии живого / В.И. Слесарев. – СПб.: Химиздат, 2001. – С. 124-139.
5. Химия: общая и неорганическая [Электронный ресурс] / сост. Ю.Я. Харитонов, Т.К. Слонская; ГОУ ВПО Моск. мед. акад. им. И.М. Сеченова; Фармац. фак.; Центр. науч. мед. б-ка. – Электрон. дан. – М.: Русский врач, 2004. – 1 электрон. опт. диск (СD- версия). – Загл. этикетки диска. – (Электрон. б-ка для высш. мед. и фармац. образования).
6. Глинка, Н.Л. Общая химия: учебник/ Н.Л. Глинка – М.: КНОРУС, 2010. –
С. 217-236.
7. Ахметов, Н.С. Общая и неорганическая химия: учебник / Н.С. Ахметов. –
6-е изд. стер. - М.: ВШ, 2005.- С. 139-149.
8. Глинка, Н.Л. Задачи и упражнения по общей химии/ Н.Л. Глинка. - М.: Интеграл–Пресс, 2008. - С. 95-103.
