Задачи для самостоятельного решения. 3.1. Растворимость CaCO3 при 35оС равна 6,9∙10–5 моль/л
3.1. Растворимость CaCO3 при 35оС равна 6,9∙10–5 моль/л. Вычислить произведение растворимости этой соли.
3.2. Вычислить произведение растворимости PbBr2 при 25 оС, если растворимость соли при этой температуре равна 1,32∙10–2 моль/л.
3.3. В 500 мл воды при 18 оС растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
3.4. Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
3.5. Исходя из произведения растворимости карбоната кальция, найти массу CaCO3, содержащуюся в 100 мл его насыщенного раствора.
3.6. Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
3.7. Вычислить объем воды, необходимый для растворения при 25оС 1г BaSO4.
3.8. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
3.9. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 оС?
3.10. Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
3.11. К 50 мл 0,001 н. раствора HCl добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
3.12. Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
3.13. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl- в растворе стала равной 0,03 моль/л?
3.14. Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
3.15. Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде?
3.16. В каком из указанных случаев раствор электролита МХ ненасыщен: а) [Mz+][Xz-] < ПР; б) [Mz+][Xz-] = ПР; в) [Mz+][Xz-] > ПР?
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Примеры решения задач
Пример 1. Концентрация ионов водорода в растворе равна 4∙10–3 моль/л. Определить рН раствора.
Решение: рН = -lg(4∙10–3) = -(lg4 + lg10-3)=3-0,6=2,4
Пример 2. Определить концентрацию [H+] в растворе, рН которого равен 4,60.
Решение: рН = -lg[H+] = 4,6; Перенесем знак минус lg[H+]=-рН=-4,6; чтобы мантисса логарифма стала положительной величиной, произведем следующее действие 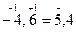 следовательно, [H+] = 2,5∙10–5 моль/л.
следовательно, [H+] = 2,5∙10–5 моль/л.
Пример 3. Чему равна концентрация [OH–] в растворе, рН которого равен 10,80?
Решение: Из соотношения рН + рОН = 14 имеем рОН = 14 – рН = 3,20.
Отсюда -lg[OH–] = 3,2; lg[OH–] = -3,20= 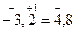 .
.
Этому значению логарифма соответствует значение
[OH–] = 6,31∙10–4 моль/л.
Пример.4. Определить концентрацию HCO3– и CO32– в 0,01М растворе H2CO3, если рН этого раствора равен 4,18.
Решение: Найдем концентрацию [H+] в растворе
-lg[H+] = 4,18; 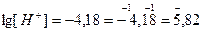
[H+] = 6,61∙10–5 моль/л
H2CO3  H++HCO3– диссоциация по первой ступени
H++HCO3– диссоциация по первой ступени
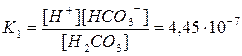
Подставляя значения [H+] и [H2CO3], находим
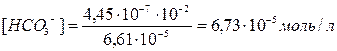
HCO3– 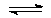 H++CO32– диссоциация по второй ступени
H++CO32– диссоциация по второй ступени
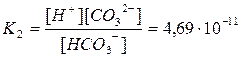
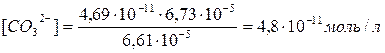 .
.
