Расчет теплового эффекта реакции по стандартным теплотам сгорания реагирующих веществ
Пример. Определите тепловой эффект реакции синтеза акриловой кислоты:
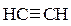 + СО+ Н2О(ж) → СН2=СН–СООН(ж),
+ СО+ Н2О(ж) → СН2=СН–СООН(ж),
Если стандартные теплоты сгорания ацетилена, оксида углерода и акриловой кислоты соответственно равны (кДж/моль): –1299,63, –282,50 и
–1370,0.
Решение. Из закона Гесса следует, что тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции (ΔНосгор..н2о=0, так как Н2О – высший оксид);
∆Hºp = Σ∆Hºсгор.(исх.) – Σ∆Hºсгор.(прод.)
ΔНо = ΔНосгор.(СН=СН) + ΔНосгор.(СО) – ΔНосгор. (СН2=СН–СООН(ж))=
–1299,63 – 282,50 + 1370,0 = –212,13 кДж/моль.
ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ЭНЕРГИИ ГИББСА
Определение возможности протекания процесса по величине изменения энергии Гиббса.
Пример. Возможна ли следующая реакция в стандартных условиях:
t
SiО2 (к) + 2NaОH (p) = Na2SiО3 (к) + Н2О (ж)
если ΔGо(SiО2 (к)) = –803,75 кДж/моль; ΔGо (Na2SiО3 (к))= –1427,8 кДж/моль;
ΔGо (NaОH(p)) = –419,5 кДж/моль; ΔGо (Н2О (ж)) = –237,5 кДж/моль?
Можно ли выпаривать щелочь в стеклянном сосуде?
Решение. Изменение энергии Гиббса ΔGо298 реакции равно:
ΔGо = ΣGопрод. – ΣGоисх.;
ΔGо298 = (–1427,8 – 237,5) – (–803,75 –419,5·2)= –22,55 кДж;
ΔGо298 = –22,55 кДж (т. е. ΔG<0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiО2.
Пример. Вычислить ΔGо для реакции 2Н2 (г)+О2 (г)  2Н2О(г).
2Н2О(г).
при 298, 500, 1000, 1500 К. Зависимостью ΔНо и ΔSo от температуры пренебречь. Построить график зависимости ΔGо от температуры и найти по графику температуру, ниже которой указанная реакция в стандартных условиях может протекать самопроизвольно.
Решение. Согласно уравнению ΔG = ΔН – TΔS влияние температуры на ΔG определяется знаком и величиной ΔS. Если пренебречь влиянием Т на значения ΔН и ΔS, то приведённая зависимость ΔG =ƒ(T) является уравнением прямой, наклон которой определяется знаком ΔS. при ΔS>0 прямая идет вниз, при ΔS<0 – вверх.
Определим величину ΔН°298 (исходные данные берем из табл.1)
∆Hºp = Σ∆Hºобр.(прод.) – Σ∆Hºобр.(исх..)
ΔН°298 = 2ΔН°обр.(H2O) – (2ΔН°обр.(H2) + 2ΔН°обр.(O2) = 2ΔН°обр.(H2O) =
=2(-241,84) = –483,68 (кДж) (на 2 моля H2O)
ΔН°обр.(Н2О) = 0,5(–483,8) = –241,89 кДж/моль.<0
Следовательно, реакция экзотермическая.
Определим изменение энтропии данной реакции в стандартных условиях ΔS°298 (исходные данные берем из табл.1)
ΔSо = ΣSопрод. – ΣSоисх.:
ΔS°298= 2S°298.(H2O) – [2S°298.(H2) + S° 298.(O2)]= 2·188,74 – (2·130.6 + 205) =
–98,6(Дж/ К) = –0,0986(кДж/ К) < 0, ΔG =ƒ(T) прямая идет вверх.
Определим изменение энергии Гиббса ΔG°298 в стандартных условиях (исходные данные берем из табл.1):
ΔGо = ΣGопрод. – ΣGоисх.;
ΔG°298 = 2ΔG°298.(H2O) – [2ΔG°298(H2) – ΔG°298(O2)] = 2(–228,8) = –457,6 кДж.
Отрицательная величина ΔG°298 свидетельствует о том, что в стандартных условиях реакция самопроизвольно протекает в прямом направлении.
ΔG°298 = ΔН°298 – 298·ΔS0298 = –483,68 – 298·(–0,0986) = –457,6кДж
ΔG°500 = ΔН°298 – 500·ΔS0298 = –483,68 – 500·(–0,0986) = –434,38кДж
ΔG°1000 = ΔН°298 – 1000·ΔS0298 = –483,68 – 1000·(–0,0986) = –385,08кДж
ΔG°1500 = ΔН°298 – 1500·ΔS0298 = –483,68 – I500·(–0,0986) = –335,78 кДж
Построим график ΔG°Т =f(Т):
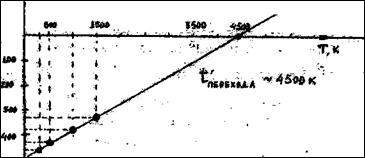 ΔG°Т
ΔG°Т
Температура перехода ~4500 К
РЕКОМЕНДАЦИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ И ВАРИАНТЫ ЗАДАНИЙ
РЕКОМЕНДАЦИИ:
1. Внимательно изучить теоретический материал, используя конспекты лекций, данное учебное пособие и рекомендуемую литературу.
2. Проверить усвоение теории, ответив на контрольные вопросы, выполнив тестовые задания.
3. Разобрать примеры решения типовых задач.
