Молярная концентрация эквивалента (нормальная концентрация)
8. Сколько (г) Na2CO3 требуется для приготовления 1,5 л раствора с молярной концентрацией эквивалента 0,15 моль/л. Раствор предназначен для реакции, протекающей до конца.
Дано: V(p-p) = 1,5 л 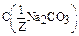 =0,15 моль/л m(Na2CO3) = ? =0,15 моль/л m(Na2CO3) = ? | Решение: Пример реакции: Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O fэкв.(Na2CO3) = 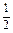 ; ; 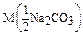 = = 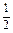 .106 = 53 г/моль; m(Na2CO3)= .106 = 53 г/моль; m(Na2CO3)= 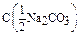 .V(p-p). .V(p-p). 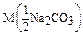 = 0,15.1,5.53 = 11,925 г. Ответ: 11,925 г. = 0,15.1,5.53 = 11,925 г. Ответ: 11,925 г. |
9. Сколько (мл) раствора СаСl2 с массовой долей 10% (r = 1,04 г/мл) необходимо для приготовления 2 л раствора с молярной концентрацией эквивалента 0,05 моль/л? Раствор предназначен для реакции, идущей до конца.
Дано: w1%(СaCl2) = 10%= 0,1 r(p-p1) = 1,04 г/мл V(p-p 2) = 2 л 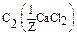 =0,05моль/л V(p-p 1) = ? =0,05моль/л V(p-p 1) = ? | Решение: Пример реакции: CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2 fэкв.(CaCl2) = 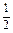 ; ; 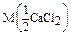 = = 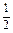 .111 = 55,5 (г/моль) m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) = .111 = 55,5 (г/моль) m(СaCl2) = V(p-p1). r(p-p1).w1(СaCl2) = |
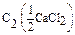 .
. 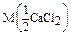 .V(p-p2)
.V(p-p2) 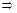 V(p-p1) =
V(p-p1) = 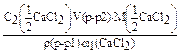
= 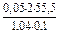 = 53,35 (мл).
= 53,35 (мл).
Ответ: 53,35 мл.
10. Определите нормальную концентрацию (молярную концентрацию эквивалента) 50,1%-ного раствора H2SO4 с плотностью 1,4 г/мл. Раствор предназначен для реакции, идущей до конца.
Дано: w1%(H2SO4)= 50,1% r(p-p1) = 1,4 г/мл 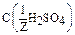 = ? = ? | Решение: I вариант: Пример реакции: H2SO4 + 2 KOH = K2SO4 + H2O fэкв.(H2SO4) = 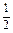 ; ; 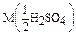 = = 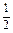 .98 = 49 г/моль Пусть V(p-p) = 1000 мл = 1 л; тогда: .98 = 49 г/моль Пусть V(p-p) = 1000 мл = 1 л; тогда: |
m(р-р) = r(p-p).V(p-p) = 1,4.1000 = 1400 (г);
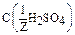 =
= 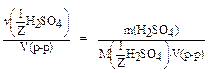 =
=
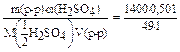 = 14,2 моль/л (или 14,2н)
= 14,2 моль/л (или 14,2н)
II вариант: При решении задачи можно использовать формулу, приведённую в таблице 3 Приложения:
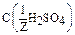 =
= 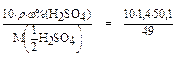 = 14,2 (моль/л).
= 14,2 (моль/л).
Ответ: 14,2 моль/л.
11. Определите нормальную концентрацию 0,5М раствора Al2(SO4)3, предназначенного для реакции образования гидроксида алюминия.
Дано: C(Al2(SO4)3) = 0,5M 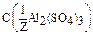 = ? = ? | Решение: Пример реакции: Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4 fэкв.( Al2(SO4)3) = 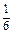 ; ; 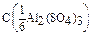 = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л Ответ: 3 моль/л (или 3 N). = 6. C(Al2(SO4)3) = 6.0,5 = 3 моль/л Ответ: 3 моль/л (или 3 N). |
12. Определите титр 0,15 N раствора Na2CO3, предназначенного для реакции полного ионного обмена (см. задачу 8).
Дано: 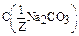 = 0,15 моль/л t(Na2CO3) = ? = 0,15 моль/л t(Na2CO3) = ? | Решение: fэкв.(Na2CO3) = 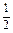 ; t(Na2CO3) = ; t(Na2CO3) = 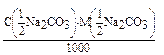 = = 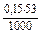 = 0,007950 (г/мл). Ответ: 0,007950 г/мл. = 0,007950 (г/мл). Ответ: 0,007950 г/мл. |
Моляльная концентрация
13. Рассчитайте моляльность 40%-ного раствора HNO3.
| Дано: w(HNO3) = 40% в(HNO3) = ? | Решение: пусть m(p-p) = 100 г, тогда: m(HNO3) = m(p-p). w(HNO3) = 100.0,4 = 40 г; |
m(H2О) = m(p-p) -m(HNO3) = 100 -40 = 60 (г) = 0,06 (кг);
в(HNO3) = 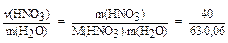 = 10,6 (моль/кг).
= 10,6 (моль/кг).
Ответ: 10,6 моль/кг.
Вопросы и задачи для самоподготовки.
1. Каково содержание понятия «раствор»?
2. Какие существуют приближённые способы выражения концентрации растворов? Перечислите, дайте краткую характеристику каждому.
3. Какие способы выражения концентрации растворов относятся к точным? Перечислите.
4. Что понимают под массовой долей?
5. Чем отличается процентная концентрация от массовой доли?
6. Что понимают под молярной концентрацией?
7. Что такое эквивалент, фактор эквивалентности, молярная масса эквивалента? Приведите примеры определения.
8. Что понимают под молярной концентрацией эквивалента (нормальной концентрацией)?
9. Что такое титр раствора?
10. Как математически связаны между собой С(Х) и w(Х), С( 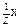 ) и С(Х), С(
) и С(Х), С( 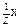 ) и w(Х)?
) и w(Х)?
11. Как математически связаны между собой С( 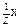 ) и t(Х)?
) и t(Х)?
12. Сколько (моль) FeSO4.7H2O надо прибавить к 100 мл воды, чтобы получить 10%-ный раствор FeSO4? Ответ: 0,18 моль.
13. К 250 г 10%-ного раствора кислоты добавили 500 г раствора той же кислоты с неизвестной массовой долей и получили 25%-ный раствор. Определите массовую долю кислоты в добавленном растворе. Ответ: 32,5%.
14. 125 л хлороводорода (н.у.) растворили в 500 мл воды. Определите массовую долю HCl в полученном растворе. Ответ: 29%.
15. В каком объёме 1 М раствора серной кислоты содержится 4,9 г H2SO4? Ответ: 50 мл.
16. Сколько (мл) 20%-ного раствора соляной кислоты с плотностью 1,098 г/мл потребуется для приготовления 1 л 2 М раствора?
Ответ: 332,4 мл.
17. Сколько (мл) 0,5 N раствора ВaСl2 можно приготовить из 24,4 г ВаСl2.2Н2О? Ответ: 400 мл.
18. Вычислите нормальную концентрацию и титр Н3РО4 в 13%-ном растворе, плотность которого 1,07 г/мл. Раствор предназначен для реакции, идущей до конца. Ответ: 4,26 N; 0,139174 г/мл.
19. В какой массе эфира надо растворить 3,04 г анилина C6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг? Ответ: 109 г.
20. Какой объём 3 N раствора должен быть прибавлен к 900 мл 0,5 N раствора этого же вещества, чтобы концентрация стала 1 N?
Ответ: 225 мл.
21. На реакцию с раствором, содержащим 0,498 г Na2B4O7.10H2O, израсходовано 25,2 мл раствора HCl. Вычислите молярную концентрацию эквивалента (нормальную концентрацию) раствора соляной кислоты. Ответ: 0,1032 N.
