Механизм электрохимической коррозии. Коррозия металла в средах, имеющих ионную проводимость
Коррозия металла в средах, имеющих ионную проводимость, протекает через анодное окисление металла
 М – ne Мn+
М – ne Мn+
и катодное восстановление окислителя (ОХ)
 ОХ + ne Red.
ОХ + ne Red.
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы Н+, Fe3+, NO3- и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода
в нейтральной или щелочной среде
 О2 + 2Н2О +4е 4ОН;
О2 + 2Н2О +4е 4ОН;
в кислой среде
 О2 + 4Н+ + 4е 2Н2О,
О2 + 4Н+ + 4е 2Н2О,
а также выделение водорода
 2Н+ + 2е 2Н2О.
2Н+ + 2е 2Н2О.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией (рис. 5.1). Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией (рис. 5.2).
Рис. 5.1. Схема коррозии стали при Рис. 5.2. Схема коррозии стали в
контакте с поглощением кислорода растворе Н2SO4 с выделением
(атмосферная коррозия) водорода
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Помимо электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций:
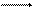 Мn+ + nОН М(ОН)n.
Мn+ + nОН М(ОН)n.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроды в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты.
Схема электрохимической коррозии железа в контакте с углеродом приведена на рис. 5.2. На анодных участках происходит реакция окисления железа
 Fe – 2e Fe2+,
Fe – 2e Fe2+,
на катодных участках происходит восстановление водорода
 2Н + 2е Н2.
2Н + 2е Н2.
Причинами энергетической неоднородности поверхности металла и сплава могут быть неоднородность сплава по химическому и фазовому составам, наличие примесей в металле, пленок на его поверхности и т.д. В результате указанного на поверхности металла могут быть участки, на которых катодные процессы протекают быстрее (катализируются), чем на других участках, и их называют катодными. На других участках будет протекать в основном растворение металла, и их называют анодными. Катодные и анодные участки чередуются, имеют микроразмеры, и на поверхности, подвергшейся коррозии, их число огромно. В случае, если неоднородность металла невелика и отсутствуют участки, катализирующие катодные реакции, катодные и анодные процессы идут по всей поверхности металла, но значительно медленнее.
