Общие закономерности химических процессов
Гомогенные и гетерогенные реакции. Зависимость скорости реакции от концентрации. Закон действия масс. Константа скорости химической реакции. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Представления о теории активных столкновений. Энергия активации.
ХИМИЧЕСКАЯ КИНЕТИКА
1. Гомогенной является реакция … .
1) СаСО3 (т) + 2НСl (р-р) = СаСl2 (р-р) + Н2О (ж) + СО2 (г)
2) 2SО2 (г) + О2 (г) = 2SО3 (г)
3) S (т) + О2 (г) = SО2 (г)
4) С (т) + СО2 (г) = 2СО (г)
2. Гетерогенной является реакция … .
1) Zn (к) + Н2О (г) = ZnО (к) + Н2 (г)
2) Н2 (г) + I2 (г) = 2НI (г)
3) 4НСl (г) + О2 (г) = 2Сl2 (г) + 2Н2О (г)
4) 2Н2О (г) = 2Н2 (г) + О2 (г)
3. Увеличение скорости химической реакции при повышении температуры обусловлено увеличением … .
1) энергии активации молекул
2) числа активных молекул
3) общего числа молекул
4) объёма системы
4. При увеличении концентрации вещества А в 2 раза и уменьшении концентрации вещества В в 2 раза скорость реакции 2А + В = 2АВ … .
1) возрастёт в 2 раза 2) возрастёт в 4 раза
3) уменьшится в 2 раза 4) не изменится
5. На каталитический характер реакции указывает увеличение интенсивности … .
1) горения угля при его измельчения
2) горения фосфора при внесении его в атмосферу кислорода
3) разложения пероксида водорода в присутствии оксида марганца(IV)
4) окисление серы при подаче кислорода
6. Скорость гетерогенной реакции
А (г) + В (т) = АВ (г)
определяется уравнением … .
1) 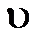 = k · сА 2)
= k · сА 2) 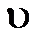 = k · сВ
= k · сВ
3) 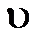 = k · сАВ 4)
= k · сАВ 4) 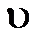 = k · сА · сВ
= k · сА · сВ
7. Для увеличения скорости гомогенной реакции 2NО + О2 = 2NО2 в 1000 раз давление необходимо увеличить в … раз(а).
1) 2 2) 5 3) 10 4) 20
8. Константа скорости химической реакции – это … .
1) скорость движения реагирующих веществ в газообразном состоянии
2) число соударений реагирующих частиц
3) скорость реакции при равных концентрациях реагирующих веществ
4) скорость реакции при единичных концентрациях реагирующих веществ
9. К изменению константы скорости химической реакции может привести изменение … .
1) давления или объёма системы
2) температуры системы
3) концентрации исходных веществ
4) концентрации продуктов реакции
10. Если при неизменной температуре концентрацию водорода в системе
N2 (г) + 3Н2 (г)  2NН3 (г)
2NН3 (г)
увеличить в 3 раза, то скорость прямой реакции … .
1) увеличится в 3 раза 2) уменьшится в 3 раза
3) увеличится в 27 раз 4) увеличится в 9 раз
11. Если при неизменной температуре давление в системе
FеО(т) + СО(г)  Fе(т) + СО2 (г)
Fе(т) + СО2 (г)
увеличить в 2 раза, то скорость прямой реакции … .
1) увеличится в 2 раза 2) уменьшится в 2 раза
3) увеличится в 4 раза 4) увеличится в 6 раз
12. Если при неизменной температуре давление в системе
СО (г) + Н2 (г)  С (т) + Н2О (г)
С (т) + Н2О (г)
уменьшить в 4 раза, то скорость обратной реакции … .
1) не изменится 2) увеличится в 4 раза
3) уменьшится в 4 раза 4) уменьшится в 16 раз
13. Для увеличения скорости реакции
2СО (г)  СО2 (г) + С (т)
СО2 (г) + С (т)
в 4 раза концентрацию оксида углерода(II) необходимо увеличить в … раза.
1) 1,5 2) 2 3) 2,5 4) 3
14. Температурный коэффициент скорости большинства химических реакций принимает значения в пределах … .
1) 1 – 4 2) 2 – 4 3) 2 – 6 4) 1 – 6
15. Если температурный коэффициент скорости химической реакции равен 3, то ее скорость при повышении температуры на 20 0С … .
1) увеличится в 3 раза 2) увеличится в 9 раз
3) уменьшится в 3 раза 4) увеличится в 6 раз
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Гомогенный и гетерогенный катализ. Обратимые и необратимые реакции. Константа равновесия. Смещение химического равновесия. Принцип Ле Шателье.
1. Константа равновесия обратимой химической реакции изменяется при … .
1) изменении давления
2) изменении температуры
3) введении катализатора
4) изменении концентрации реагирующих веществ
2. Химическое равновесие смещается влево при понижении температуры в системе … .
1) С (т) + Н2О (г)  СО (г) + Н2 (г) , DН = 131,4 кДж
СО (г) + Н2 (г) , DН = 131,4 кДж
2) Н2 (г) + Сl2 (г)  2НСl (г) , DН = –175,7 кДж
2НСl (г) , DН = –175,7 кДж
3) РСl5 (г)  РСl3 (г) + Сl2 (г) + Q
РСl3 (г) + Сl2 (г) + Q
4) СО (г) + Сl2 (г)  СОСl2 (г) – 109,6 кДж
СОСl2 (г) – 109,6 кДж
3. Понижение температуры вызывает смещение химического равновесия вправо в системе … .
1) СО (г) + Н2О (г)  Н2 (г) + СО2 (г) , DН = 0,8 кДж
Н2 (г) + СО2 (г) , DН = 0,8 кДж
2) С (т) + СО2 (г)  2СО (г) , DН = 130,5 кДж
2СО (г) , DН = 130,5 кДж
3) 4НСl (г) + О2 (г)  2Н2О (г) + 2Сl2 (г) + 117,2 кДж
2Н2О (г) + 2Сl2 (г) + 117,2 кДж
4) Н2 (г) + I2 (г)  2НI (г) + Q
2НI (г) + Q
4. Повышение давления практически не влияет на химическое равновесие в системе … .
1) 2SО2 (г) + О2 (г)  2SО3 (г)
2SО3 (г)
2) N2 (г) + 3Н2 (г)  2NН3 (г)
2NН3 (г)
3) FеО (т) + СО (г)  Fе (т) + СО2 (г)
Fе (т) + СО2 (г)
4) 3NО2 (г) + Н2О (ж)  2НNО3 (ж) + NО (г)
2НNО3 (ж) + NО (г)
5. Химическое равновесие смещается вправо при повышении давления в системе … .
1) 2NО (г) + О2 (г)  2NО2 (г)
2NО2 (г)
2) 2Н2О (г)  2Н2 (г) + О2 (г)
2Н2 (г) + О2 (г)
3) N2О4 (г)  2NО2 (г)
2NО2 (г)
4) СаСО3 (т)  СаО (т) + СО2 (г)
СаО (т) + СО2 (г)
6. Для подавления окисления оксида углерода (II) по реакции
2СО (г) + О2 (г)  2СО2 (г) (DН < 0)
2СО2 (г) (DН < 0)
необходимо … .
1) уменьшить температуру 2) увеличить давление
3) уменьшить давление 4) ввести катализатор
7. Фактором, способствующим термическому разложению известняка по реакции
СаСО3 (т)  СаО (т) + СО2 (г) – Q ,
СаО (т) + СО2 (г) – Q ,
является … .
1) повышение температуры
2) повышение давления
3) введение катализатора
4) увеличение концентрации оксида углерода(IV)
8. Смещение химического равновесия в системе
Н2 (г) + Сl2 (г)  2НСl (г) (DН < 0)
2НСl (г) (DН < 0)
влево вызывает … .
1) повышение температуры 2) понижение температуры
3) добавление катализатора 4) увеличение давления
9. Повышение выхода оксида углерода(II) по реакции
СО2 (г) + Н2 (г)  СО (г) + Н2О (г)
СО (г) + Н2О (г)
вызывает … .
1) увеличение давления
2) уменьшение давления
3) увеличение концентрации водорода
4) увеличение концентрации оксида углерода(IV)
10. Подавление разложения оксида марганца (IV) следует при …
4МnО2 (т)  2Мn2О3 (т) + О2 (г) (DН = 229,3 кДж)
2Мn2О3 (т) + О2 (г) (DН = 229,3 кДж)
1) повышении температуры 2) повышении давления
3) понижении давления 4) введении катализатора
11. Для подавления прямой реакции
СаСО3 (т)  СаО (т) + СО2 (г) (DН > 0)
СаО (т) + СО2 (г) (DН > 0)
необходимо … .
1) понизить температуру 2) понизить давление
3) повысить температуру 4) ввести катализатор
12. Для смещения химического равновесия в системе
SО2 (г) + Сl2 (г)  SО2Сl2 (г) (DН < 0)
SО2Сl2 (г) (DН < 0)
влево необходимо … .
1) понизить температуру
2) понизить давление
3) ввести катализатор
4) повысить концентрацию оксида серы (IV)
13. Для увеличения выхода продуктов реакции
2Рb(NО3)2 (т)  2РbО (т) + 4NО2 (г) + О2 (г) (DН > 0)
2РbО (т) + 4NО2 (г) + О2 (г) (DН > 0)
необходимо … .
1) понизить температуру 2) уменьшить давление
3) увеличить давление 4) увеличить температуру
14. Для повышения эффективности синтеза аммиака по реакции
N2 (г) + 3Н2 (г)  2NН3 (г) (DН < 0)
2NН3 (г) (DН < 0)
необходимо … .
1) повысить температуру
2) повысить давление
3) понизить концентрацию азота
4) повысить концентрацию аммиака
15. Для эффективного окисления азота по реакции
N2 (г) + О2 (г)  2NО (г) (DН = 180 кДж)
2NО (г) (DН = 180 кДж)
необходимо … .
1) повысить температуру 2) повысить давление
3) понизить температуру 4) понизить давление
