Электродные потенциалы
В реакциях окисления-восстановления электроны хаотично переходят от восстановителя к окислителю. Если эти процессы пространственно разделить так, чтобы переход электронов совершался направленно по металлическому проводнику, то получим электрический ток. Окислительно-восстановительные реакции, протекающие с образованием электрического тока или под действием электрического тока, называются электрохимическими процессами.
Рассмотрение электрохимических процессов начнем с электродных потенциалов.
При погружении металла в раствор его соли происходит окисление металла и его гидратированные ионы переходят в раствор, заряжая последний положительно. Электроны, остающиеся в металле, заряжают его отрицательно.
Разность потенциалов, возникающая между поверхностью металла и раствором, называется электродным потенциалом, а система металл-раствор называется электродом. Так как процесс ионизации металла обратимый процесс, то через некоторое время возникает равновесие: сколько ионов переходит в раствор за единицу времени, столько же их на металле теряют заряд.

 Ме + mH2O Me (H2O)mn+ + ne
Ме + mH2O Me (H2O)mn+ + ne
В условиях равновесия образующийся между металлом и раствором потенциал наывается равновесным потенциаломи обозначается е.
Определить абсолютное значение потенциалов невозможно. Однако можно определить значение потенциала относительно другого электрода. В качестве такого электрода сравнения используется стандартный водородный электрод, потенциал которого принимается равным нулю. Данный электрод состоит из платиновой пластинки, погруженной в раствор серной кислоты, где концентрация СН+ равна 1моль/л. Через раствор пропускается водород (давление 1 атм.), который адсорбируется пластиной. Часть водорода становится атомами и ионизируется:
Н2 = 2Н+

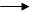 Н Н+ + е-
Н Н+ + е-
Образуется водородный электрод, который обозначается
Pt (H2)/2H+
При определении стандартного потенциала металла, его электрод соединяется с водородным электродом и измеряется значение разности потенциалов.
Электродный потенциал растворения металла, погружённого в раствор его соли, измеренный в стандартных условиях по отношению к потенциалу стандартного водородного электрода, называется стандартным потенциалом.
Стандартные условия: С = 1 моль/л, t = 23 – 25oC , P = 1 атм.
Расположив металлы в ряд по мере увеличения их стандартных электродных потенциалов (e0), получим ряд, называемый рядом стандартных электродных потенциалов металлов. Положение металла в этом ряду характеризует его химическую активность в растворе.
В начале ряда помещены активные металлы с малым значением потенциала. Малоактивные металлы располагаются после водорода и имеют положительные значения потенциалов. Между активными металлами и мало активными располагаются металлы средней активности (условно от марганца e0Mn2+/Mn= -1.18В до H.
Стандартные потенциалы металлических электродов приводятся в таблице (t=25оС).
Таблица 1.
| Электрод | Е0,В | Электрод | Е0,В |
| Li / Li+ Rb / Rb+ K / K+ Cs / Cs+ Ba / Ba2+ Sr / Sr2+ Ca / Ca2+ Na / Na+ La / La3+ Mg / Mg2+ Sc / Sc3+ Be / Be2+ U / U3+ Al / Al3+ Ti / Ti2+ Ti / Ti4+ Mn / Mn2+ V / V 2+ Cr / Cr2+ | -3.05 -2.93 -2.92 -2.92 -2.91 -2.89 -2.87 -2.71 -2.52 -2.36 -2.08 -1.85 -1.80 -1.66 -1.63 -1.23 -1.18 -1.17 -0.91 | Zn / Zn2+ Cr / Cr3+ Fe / Fe2+ Cd / Cd2+ Tl / Tl+ Co / Co2+ Ni / Ni2+ Sn / Sn2+ Pb / Pb2+ Fe / Fe3+ H2 / 2H+ Bi / Bi3+ Cu / Cu2+ Cu / Cu+ Ag / Ag+ Hg / Hg2+ Pt / Pt2+ Au / Au3+ Au / Au+ | -0.76 -0.74 -0.44 -0.40 -0.34 -0.28 -0.25 -0.14 -0.13 -0.04 -0.00 +0.21 +0.34 +0.52 +0.80 +0.85 +1.19 +1.50 +1.70 |
Из этой таблицы следует:
1) чем меньше е0, тем металл химически активнее, тем он легче окисляется и труднее восстанавливается из своих ионов.
2) металлы, имеющие е0< 0 В вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (H2SO4,HCL и др.).
3) металлы вытесняют (восстанавливают ) все другие металлы, имеющие более высокое значение е0 из растворов их солей.
4) чем больше разность потенциалов у двух металлов, тем больше величина ЭДС.
Пример.
Будет ли взаимодействовать алюминий с раствором сульфата никеля?
Решение: по таблице находим
e0Al+3/Al = -1.66В
е0Ni2+/Ni = - 0.25В
Потенциал Al меньше, следовательно, алюминий более сильный восстановитель, чем никель, от него электроны будут переходить к ионам никеля:
2Al + 3NiSO4 = Al2(SO4)3 + 3Ni
Фактически протекает реакция:
2Al0 + 3Ni2+ = 2Al+3 + 3Ni
Пример.
Цинк может вытеснять водород из растворов кислот, так как e0Zn2+/Zn равен -0,76В и меньше, чем потенциал водорода.
Zn + 2HCl = ZnCl2 + H2
Zn – 2e- = Zn2+
2H+ + 2e- = H2
Медь не может вытеснять водород из растворов кислот, так как имеет потенциал +0,34, больше нуля.
Электродный потенциал зависит от природы металла температуры, концентрации ионов металла в растворе. Эта зависимость выражается уравнением Нернста:

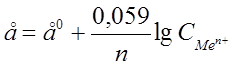 , где
, где
е0 –стандартный эдектродный потенциал;
n – число e-,принимающих участие в процессе;
СMen+ - концентрация ионов металла в растворе.
Из формулы следует, что чем больше разбавленный раствор, тем более отрицательно значение потенциала металла.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
28. В два сосуда с голубым раствором CuSO4 поместили в первый цинковую пластинку, во второй – серебряную пластинку. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
29. Увеличивается, уменьшается или остается без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a)AgNO3; b)ZnSO4; c) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
30. Увеличивается, уменьшается или остается без изменения масса цинковой пластинки при взаимодействии с растворами: a) CuSO4; b)MgSO4; c)Pb(NO3)2 ? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
31. Рассчитайте электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0,1, 0,01, 0,001 моль/л
32. Вычислите потенциал водородного электрода погруженного в чистую воду; в раствор с PH=10,7
33. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0.015 В меньше его стандартного электродного потенциала?
34. Стандартный электродный потенциал никеля больше, чем кобальта. Измениться ли это соотношение, если изменить потенциал никеля в растворе его ионов с концентрацией 0.001 моль/л, а потенциал кобальта – в растворе с концентрацией 0.1 моль/л?
35. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен –2,41 В. Вычислить концентрацию ионов магния (в моль/л).
36. Потенциал серебряного электрода в растворе нитрата серебра составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов серебра (в моль/л)?
37. При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода.
38. В каком случае происходит реакция при внесении цинковой, железной и свинцовой пластинок в раствор сульфата олова (II). Напишите молекулярные и электронные уравнения реакций.
39. В какой пробирке происходит реакция при внесении цинковых пластинок в пробирки с растворами сульфата меди и сульфата магния. Напишите молекулярные и электронные уравнения реакций.
40. В какой пробирке происходит реакция при внесении цинковых пластинок в разбавленные растворы серной кислоты гидроксида калия сульфата магния? Напишите молекулярные и электронные уравнения реакций.
41. Увеличится, уменьшится, или останется без изменений масса железной пластинки при внесении ее в раствор сульфата меди (II) , сульфата калия. Почему? Напишите молекулярные и электронные уравнения реакций.
42. Какова масса технического железа, содержащего 18% примесей, требуется для вытеснения из раствора сульфата никеля (II) 7,42 г. никеля.
43. В раствор нитрата серебра опущена медная пластинка массой 28г. По окончании реакции пластинка была вынута из раствора, обмыта, высушена и взвешена. Масса ее оказалась 32,75 г. Какая масса нитрата серебра была в растворе.
44. Потенциал водородного электрода равен –0,145 В. определите рН раствора.
45. С какими из перечисленных ниже веществ будет реагировать железо: а) Хлороводородная кислота б) сульфат цинка в) нитрат серебра. Напишите молекулярные и электронные уравнения реакций.
46. Потенциал водородного электрода в некотором водном растворе равен –118мВ. Вычислить концентрацию ионов водорода в этом растворе.
47. В два сосуда с розовым раствором сульфата кобальта (II) опустили железную и медную проволоки. В каком сосуде цвет раствора постепенно изменяется и почему? Напишите молекулярные и электронные уравнения реакций.
