Термодинамика и скорость электрохимической коррозии
Коррозия как самопроизвольный процесс протекает, если энергия Гиббса реакции DG имеет отрицательное значение. Так как энергия Гиббса реакции непосредственно связана с ЭДС элемента ЕЭ = -(DG/nF), то возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС элемента имеет положительное значение (ЕЭ > 0), то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя ЕЭ = Еок – Евосст,то коррозиявозможна при условии, что потенциал окислителя положительнее потенциала металла:
Еок > 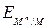 . (5.9)
. (5.9)
Уравнение (5.9) позволяет определить возможность протекания коррозии различных металлов.
Если потенциал металла положительнее потенциала кислородного электрода, то коррозия металла невозможна.
Если потенциал металла положительнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода.
Разность потенциалов металла и окислителя определяет возможность коррозии. Большинство металлов может корродировать с поглощением кислорода и лишь некоторые металлы – с выделением водорода.
Важной характеристикой коррозии металлов служит ее скорость, выражаемая через потери в единицу времени. Скорость коррозии может быть также выражена по закону Фарадея через ток или плотность тока.
Электрохимическая коррозия протекает через несколько стадий, и ее скорость определяется скоростью самой медленной стадии, называемой лимитирующей или контролирующей.
Качественные закономерности процесса коррозии удобно изучать с помощью поляризационных коррозионных диаграмм Эванса, построенных в координатах «потенциал-ток» (рис. 5.3).
Рис. 5.3. Коррозионные диаграммы Эванса
для коррозии при контроле:
а – смешанном; б – катодном; в – анодном
В рассматриваемом на рис. 5.3,а случае ток коррозии равен 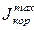 . Если сопротивление коррозионной среды и переходное сопротивление между катодными и анодными участками достаточно велики, то коррозионный ток снизится до J, и величина DU будет представлять собой общее омическое падение напряжения в цепи коррозионного элемента. Вклад катодной, анодной и омической составляющих в коррозионный процесс оказывается неодинаковым, и та составляющая, которая лимитирует процесс, оказывая наибольшее влияние на величину тока коррозии, будет контролирующей.
. Если сопротивление коррозионной среды и переходное сопротивление между катодными и анодными участками достаточно велики, то коррозионный ток снизится до J, и величина DU будет представлять собой общее омическое падение напряжения в цепи коррозионного элемента. Вклад катодной, анодной и омической составляющих в коррозионный процесс оказывается неодинаковым, и та составляющая, которая лимитирует процесс, оказывая наибольшее влияние на величину тока коррозии, будет контролирующей.
Значительная поляризуемость катодной реакции при малой поляризуемости анодной (см. рис. 5.3,б), указывает на катодный контроль коррозии. На рис. 5.3,в приведена коррозионная диаграмма для случая анодного контроля. Если решающую роль играет омическое сопротивление, то говорят об омическом контроле процесса.
Определить контролирующую составляющую коррозии не всегда удается визуально. Тогда прибегают к графическому анализу коррозионной диаграммы, как показано на рис. 5.4, где обозначены катодная поляризация DUК, анодная поляризация DUА и омическое падение напряжения DUR.
Рис. 5.3. Графический анализ
коррозионной диаграммы Эванса
Степень контроля процесса оценивается сравнением этих величин, отнесенных к разности равновесных потенциалов коррозионного элемента:
Па = DUа / (DUа + DUк + DUR);
Пк = DUк / (DUа + DUк + DUR);
ПR = DUR / (DUа + DUк + DUR).
Если ни одно из значений не имеет явного преимущества, то контроль определяется как смешанный (катодно-анодный, катодно-омический).
Равновесные потенциалы электродных реакций и сопротивление цепи, а также поляризуемость электрода зависят от природы, состава и свойств металла и электролита (коррозионной среды), а также от внешних условий – температу-ры, перемешивания и др. Таким образом, на скорость коррозии металла влияют разнообразные внешние и внутренние факторы. К внешним факторам относят все, что связано с коррозионной средой, к внутренним – все, связанное с металлом.
Коррозия металлов, способных пассивироваться, контролируется анодными реакциями. Обычно это наблюдается на таких металлах, как хром, алюминий, никель и др.
Пассивностью металла называется состояние его повышенной корро-зионной устойчивости, вызванное торможением анодного процесса. С точки зрения термодинамики пассивный металл может подвергаться коррозии, но практически не корродирует из-за того, что анодное растворение его протекает крайне медленно.
Окислители играют двойную роль в коррозионных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой (для металла, способного к пассивации) - вызвать пассивность металла и резкое торможение коррозии. Сказанное не относится к ионам Cl-, которые, наоборот, активируют металлы, препятствуя их пассивации.
