Тема 2. Термодинамика
Введение: Крайне зловещая и непонятная тема, впрочем, в физической химии понятных и нет. Оперирует страннымы бессмысленными функциями – энтальпией, энтропией и энергией Гиббса.
Типичные вопросы:
1. Энтальпия образования и сгорания.
Пример:
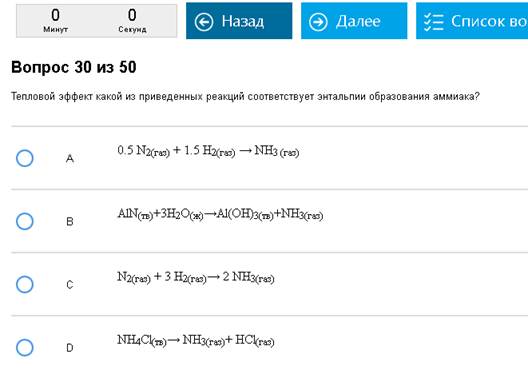
Путаный вопрос. Правильно – А, С не правильно потому, что образуется 2 молекулы аммиака, остальное неправильно потому, что аммиак получают не из простых веществ.
Как с этим бороться:
Надо осознать, что энтальпия образования этого вещества относится к реакции образования 1 молекулы (1 моля) этого вещества из простых веществ. То есть энтальпия образования метана, например, относится к реакции С + 2Н2 = СН4, и никаких других реакций. Реакции могут получаться очень странные, если кто-нибудь хорошо помнит ЕГЭ, то может заметить, что некоторые из этих реакций противоречат тому, чему учат в школе, и невозможны в жизни. Не надо смущаться этим, у термодинамики – своя атмосфера. Энтальпия реакции сгорания вещества относится к реакции сгорания 1 молекулы этого вещества до СО2, Н2О, SO2, N2 и других оксидов, если в веществе были другие атомы. Внимание на определения, молекула и в сгорании и в образовании должна быть только одна, это важно.
2. Верные и неверные утверждения.
Пример:
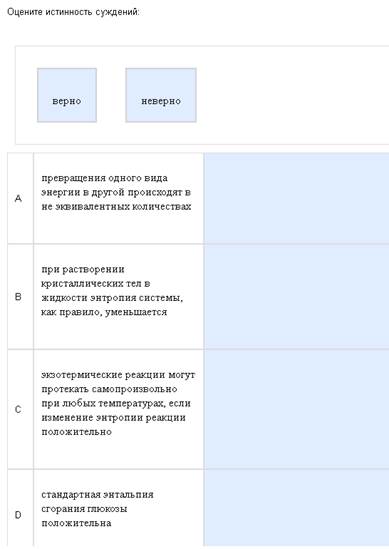
Жестокая, жестокая термодинамика…
Как с этим бороться:
Никак, смиритесь, это безнадежно. Не рассчитывайте даже на интуицию, если хоть одна из 4 формулировок будет с ошибкой, вам не зачтут вопрос, но надо быть минимум победителем «Битвы экстрасенсов», чтобы угадать все 4.
Кратко отвечу на то, что нашел. А-неверно, виды энергии превращаются как раз в эквивалентных количествах, В-неверно, при растворении энтропия возрастает, С-верно, смотреть ниже, D-неверно, все энтальпии сгорания, и энтальпия нейтрализации отрицательны. Есть легенда, что должно быть 2 верных и 2 неверных ответа, но я считаю, что это неправильно, бывает всякое. Еще есть подозрение, что кое-где ответы перепутаны, и даже если ответить правильно с точки зрения химии, то нет уверенности, что это будет правильно с точки зрения кафедры.
3. При каких температурах (высоких, низких, любых, никаких) возможна реакция?
Пример:

Пример переформатирования в сторону усложнения. Читаем слитно условие+А, получается Н=0, S<0, возможен при любой температуре. Сравниваем с таблицей ниже, понимаем, что получили неверное утверждение, при таких функциях процесс невозможен. Повторяем, читаем слитно условие+В, и так далее, до тех пор, пока не получим верного утверждения. Варианты, где есть G, могут рассматриваться отдельно от условия, потому что с G все просто, см. ниже.
Как с этим бороться:
Исходная предпосылка всех этих вопросов – Второй Закон Термодинамики, говорящий, что в закрытой системе возможен только процесс, в котором ΔG<0, а процесс ΔG>0, естественно невозможен при любых температурах. Изначально все запросто сводилось к таблице вида:
| Энтальпия ΔН | Энтропия ΔS | Возможность протекания реакции |
| <0 или =0 | >0 или =0 | При любых температурах* |
| <0 или =0 | <0 или =0 | Ни при каких температурах* |
| >0 | >0 | При высоких температурах |
| >0 | <0 | При низких температурах |
*-при условии, что обе функции не равны нулю.
Сейчас все несколько сложнее, нужно просто прочитать вопрос слитно вместе с вариантом ответа, и оценить, верное ли получилось суждение.
4. Критерий возможности.
Пример:
?
Где то потерялся.
Как с этим бороться:
Перед Новым годом видел такие вопросы, но не заскринил, а сейчас не могу найти. Вроде ничего особенного не было. См выше. Возможен только процесс, в котором ΔG<0, а процесс ΔG>0, естественно невозможен
5. Неизвестный пока науке вид задач.
Пример:
?
Нету.
Как с этим бороться:
Пока неизвестно.
