Гальванические элементы (химические источники электрического тока)
Гальванический элемент (ГЭ) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. Теоретически для получения электрической энергии можно применить любую ОВР.
 Рассмотрим один из наиболее простых ГЭ – медно – цинковый, или элемент Даниэля – Якоби (рис. 10.1). В нём проводником соединяются пластинки из цинка и меди, при этом каждый из металлов опущен в раствор соответствующей соли: сульфата цинка и сульфата меди (II). Полуэлементы соединены электролитическим ключом1, если находятся в разных сосудах или разделены пористой перегородкой, если находятся в одном сосуде.
Рассмотрим один из наиболее простых ГЭ – медно – цинковый, или элемент Даниэля – Якоби (рис. 10.1). В нём проводником соединяются пластинки из цинка и меди, при этом каждый из металлов опущен в раствор соответствующей соли: сульфата цинка и сульфата меди (II). Полуэлементы соединены электролитическим ключом1, если находятся в разных сосудах или разделены пористой перегородкой, если находятся в одном сосуде.
Рассмотрим сначала состояние этого элемента при разомкнутой внешней цепи – режим «холостого хода». На электродах в результате процесса обмена устанавливаются следующие равновесия, которым в стандартных условиях соответствуют стандартные электродные потенциалы:
Zn2+ + 2e- D Zn 
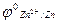 = - 0,76В
= - 0,76В
Cu2+ + 2e- D Cu 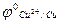 = +0,34В.
= +0,34В.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится влево, поэтому в раствор перейдёт дополнительное количество ионов цинка (растворение цинка на цинковом электроде). В то же время равновесие на медном электроде сместится вправо и произойдёт разряд ионов меди (выделение меди на медном электроде). Данные самопроизвольные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или вся медь не осадится на медном электроде).
Итак, при работе элемента Даниэля – Якоби протекают следующие процессы:
1) движение электронов во внешней цепи от цинкового электрода к медному, т.к. 
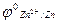 <
< 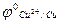 ;
;
2) реакция окисления цинка: Zn – 2e- = Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; следовательно, цинковый электрод – анод;
3) реакция восстановления ионов меди: Сu2+ + 2е = Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; следовательно, медный электрод – катод;
4) движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+,Zn2+) к катоду, замыкает электрическую цепь гальванического элемента;
5) cуммируя электродные реакции, получаем:
Zn + Cu2+ = Cu + Zn2+
или в молекулярном виде: Zn + CuSO4 = Cu + ZnSO4.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Анод – источник электронов, поступающих во внешнюю цепь – принято считать отрицательным, катод – положительным. Анод помещается в схеме слева. Схема ГЭ Даниэля – Якоби, например, записывается в виде:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
или в ионно-молекулярном виде:
(-) Zn |Zn2+ ||Cu2+| Cu (+).
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность окислительно-восстановитель-ных потенциалов (электродных потенциалов1) частных реакций, определяющих электродвижущую силу Еэ гальванического элемента, и в рассматриваемом случае:
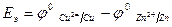 .
.
В общем случае: Еэ = jк - jа ,
где jк – потенциал катода, jа – потенциал анода.
Еэ всегда больше нуля (Еэ > О). Если реакция осуществляется в стандартных условиях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой 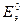 данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС
данного элемента. Для элемента Даниэля – Якоби стандартная ЭДС 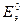 = 0,34 – (-0,76) = 1,1(В).
= 0,34 – (-0,76) = 1,1(В).
Пример.
Составьте схему, напишите уравнения электродных процессов и токообразующей реакции для гальванического элемента, образованного висмутом и железом, опущенных в растворы собственных солей с концентрацией ионов металлов в растворе CBi3+ = 0,1 моль/л, CFe2+ = 0,01 моль/л. Рассчитайте ЭДС этого элемента при 298К.
Решение.
Концентрации ионов металлов в растворе отличны от концентрации 1 моль/л, поэтому нужно рассчитать потенциалы металлов по уравнению Нернста, сравнить их и определить анод и катод.
jмеn+/ме = jомеn+/ме + 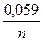 lgСмеn+;
lgСмеn+;
jBi3+/Bi = 0,21 + 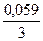 lg10-1 = 0,19В; jFе2+/Fе = -0,44 +
lg10-1 = 0,19В; jFе2+/Fе = -0,44 + 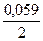 lg10-2 = - 0,499В.
lg10-2 = - 0,499В.
Железный электрод – анод, висмутовый – катод. Схема ГЭ:
(-)Fe |Fe(NO3)2||Bi(NO3)3|Bi(+)
или (-) Fe|Fe2+||Bi3+ |Bi (+).
Уравнения электродных процессов и токообразующей реакции:
 А: Fe - 2
А: Fe - 2 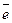 = Fe2+ 3
= Fe2+ 3
 К: Bi3+ + 3
К: Bi3+ + 3 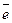 = Bi 2
= Bi 2
3 Fe + 2Bi3+ = 3Fe2+ + 2 Bi
ЭДС данного элемента Еэ = 0,19 – (-0,499) = 0,689 В.
В ряде случаев металл электрода не претерпевает изменений в ходе электродного процесса, а участвует лишь в передаче электронов от восстановленной формы вещества к его окисленной форме. Так, в гальваническом элементе
Pt |Fe2+, Fe3+|| MnO 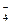 , Mn2+, H+| Pt
, Mn2+, H+| Pt
роль инертных электродов играет платина. На платиновом аноде окисляется железо (II):
Fe2+ - е- = Fe3+, 
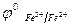
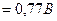 ,
,
а на платиновом катоде восстанавливается MnO 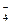 :
:
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O, 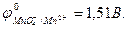 .
.
Уравнение токообразующей реакции:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
Стандартная ЭДС Е 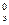 =1,51-0,77=0,74 В.
=1,51-0,77=0,74 В.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Например:
(-) Ag |Ag+||Ag+|Ag (+)
CAg 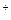 < CAg
< CAg 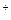
Электродные реакции: A: Ag – eˉ = Ag+;
K: Ag+ + eˉ = Ag.
Уравнение токообразующей реакции: Ag + Ag+ = Ag+ + Ag.
Свинцовый аккумулятор.Готовый к употреблению свинцовый аккумулятор состоит из решётчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие – металлическим губчатым свинцом. Пластины погружены в 35 – 40 % раствор H2SO4; при этой концентрации удельная электропроводность раствора серной кислоты максимальна.
При работе аккумулятора – при его разряде – в нём протекает ОВР, в ходе которой свинец (Pb) окисляется, а диоксид свинца восстанавливается:
(-) Рb|H2SO4| РbО2 (+)
А: Рb + SO 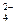 –2еˉ = РbSO4
–2еˉ = РbSO4 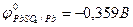
 К: РbО2 + SO
К: РbО2 + SO 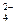 + 4Н+ + 2еˉ = PbSO4 + 2H2O
+ 4Н+ + 2еˉ = PbSO4 + 2H2O 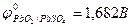
Pb + PbO2 + 4H+ + 2SO42- = 2PbSO4+ 2H2O (токообразующая реакция).  .
.
Во внутренней цепи (в растворе Н2SO4) при работе аккумулятора происходит перенос ионов: ионы SO42- движутся к аноду, а катионы Н+ - к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода – катионы. В итоге раствор остаётся электронейтральным.
Для зарядки аккумулятора подключаются к внешнему источнику постоянного тока (“+” к “+”, “–“ к “–“). При этом ток протекает через аккумулятор в обратном направлении, обратном тому, в котором он проходил при разряде аккумулятора; в электрохимической системе осуществляется электролиз (см. р. 10.2). В результате этого электрохимические процессы на электродах «обращаются». На свинцовом электроде теперь происходит процесс восстановления (электрод становится катодом):
PbSO4 + 2eˉ = Pb + SO42-.
На электроде из PbO2 при заряде идёт процесс окисления (электрод становится анодом):
PbSO4 + 2H2O - 2eˉ = PbO2 + 4H+ + SO42-.
Суммарное уравнение:
2PbSO4 + 2H2O = Pb + PbO2 + 4H+ + 2SO42-.
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора: при заряде аккумулятора в нём вновь получаются вещества, необходимые для его работы.
Электролиз
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах в растворе или расплаве электролита под действием постоянного электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Прибор, в котором проводят электролиз, называют электролизером. На отрицательном электроде электролизера (катоде) происходит процесс восстановления – присоединения окислителем электронов, поступающих из электрической цепи, а на положительном электроде (аноде) – процесс окисления – переход электронов от восстановителя в электрическую цепь.
Таким образом, распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе процессы осуществляются за счёт энергииэлектрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Для процеcсов электролиза DG>0, т.е. при стандартных условиях они самопроизвольно не идут.
 Электролиз расплавов. Рассмотрим электролиз расплава хлорида натрия (рис. 10.2). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и одного вида анионов(Cl
Электролиз расплавов. Рассмотрим электролиз расплава хлорида натрия (рис. 10.2). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и одного вида анионов(Cl  ) и никаких других частиц, могущих участвовать в электролизе, нет. Процесс электролиза расплава NaCl идёт следующим образом. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Катионы Na+ под действием электрического поля движутся к отрицательному электроду, взаимодействуя с приходящими по внешней цепи электронами. Этот электрод является катодом, и на нём идёт процесс восстановления катионов Na+. Анионы Cl
) и никаких других частиц, могущих участвовать в электролизе, нет. Процесс электролиза расплава NaCl идёт следующим образом. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Катионы Na+ под действием электрического поля движутся к отрицательному электроду, взаимодействуя с приходящими по внешней цепи электронами. Этот электрод является катодом, и на нём идёт процесс восстановления катионов Na+. Анионы Cl  движутся к положительному электроду и, отдав электроны аноду, окисляются. Процесс электролиза наглядно изображают схемой, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества. Схема электролиза расплава хлорида натрия выглядит так:
движутся к положительному электроду и, отдав электроны аноду, окисляются. Процесс электролиза наглядно изображают схемой, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества. Схема электролиза расплава хлорида натрия выглядит так:
NaCl = Na+ + Cl 
(-) Катод: Na+ Анод (+):Cl 
Na+ + e- = Na 2Cl  - 2eˉ = Cl2
- 2eˉ = Cl2
Суммарное уравнение:
 2Na+ + 2Cl
2Na+ + 2Cl  ЭЛЕКТРОЛИЗ 2Na + Cl2
ЭЛЕКТРОЛИЗ 2Na + Cl2
или в молекулярном виде
 2NaCl ЭЛЕКТРОЛИЗ 2Na + Cl2
2NaCl ЭЛЕКТРОЛИЗ 2Na + Cl2
Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, на катоде – процесс восстановления.
В процессах электролиза растворов электролитов могут участвовать молекулы воды и имеет место поляризация электродов.
Поляризация и перенапряжение. Потенциалы электродов, определённые в растворах электролитов в условиях отсутствия в цепи электрического тока, называются равновесными потенциалами (в стандартных условиях – стандартные электродные потенциалы). При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией:
Dj = j i - j р,
где Dj - поляризация;
j i – потенциал электрода при прохождении тока;
j р – равновесный потенциал электрода.
Когда известна причина изменения потенциала при прохождении тока вместо термина «поляризация», используют термин «перенапряжение». Его также относят к некоторым конкретным процессам, например, к катодному выделению водорода (водородное перенапряжение).
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от плотности тока, протекающего через электрод. Так как электроды могут быть разными по площади, то в зависимости от площади электрода при одном и том же потенциале могут быть разные токи; поэтому ток относят обычно к единице площади поверхности. Отношение тока I к площади электрода S называют плотностью тока I:
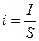 .
.
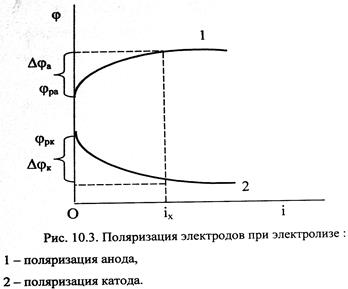 Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 10.3). При прохождении тока изменяются потенциалы электродов электролизёра, т.е. возникает электродная поляризация. Вследствие катодной поляризации (Djк) потенциал катода становится более отрицательным, а из-за анодной поляризации (Djа) потенциал анода становится более положительным.
Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 10.3). При прохождении тока изменяются потенциалы электродов электролизёра, т.е. возникает электродная поляризация. Вследствие катодной поляризации (Djк) потенциал катода становится более отрицательным, а из-за анодной поляризации (Djа) потенциал анода становится более положительным.
Последовательность электродных процессов при электролизе растворов электролитов.В процессах электролиза растворов электролитов могут участвовать молекулы воды, ионы Н+ и ОН  в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Катодные процессы.
1.1. На катоде в первую очередь идут процессы, характеризуемые наибольшим электродным потенциалом, т.е. в первую очередь восстанавливаются наиболее сильные окислители.
1.2. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (Cu2+, Ag+ , Hg2+, Au3+ и др. катионы малоактивных металлов), при электролизе практически полностью восстанавливаются на катоде:
Men+ + neˉ " Me.
1.3. Катионы металлов, потенциал которых значительно меньше, чем у водорода (стоящих в «Ряду напряжений» от Li+ до Al3+ включительно, т.е. катионы активных металлов), не восстанавливаются на катоде, так как на катоде восстанавливаются молекулы воды:
2Н2О + 2еˉ ® Н2 + 2ОН  .
.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода:
2Н+ + 2еˉ " Н2.
1.4. Катионы металлов, имеющих стандартный электродный потенциал, меньше, чем у водорода, но больше чем у алюминия (стоящих в «Ряду напряжений» от Al3+ до 2Н+ - катионы металлов средней активности), при электролизе на катоде восстанавливаются одновременно с молекулами воды:
Меn+ + neˉ ® Me
2Н2О + 2еˉ ® Н2 + 2ОН  .
.
К данной группе относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и т.д.. При сравнении стандартных потенциалов этих ионов металлов и водорода можно было бы сделать вывод о невозможности выделения металлов на катоде. Однако следует учесть:
· стандартный потенциал водородного электрода относится к ан+  [Н+]
[Н+] 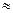 1 моль/л., т.е. рН=0; с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее (
1 моль/л., т.е. рН=0; с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее ( 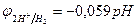 ; см. раздел 10.3); в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
; см. раздел 10.3); в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
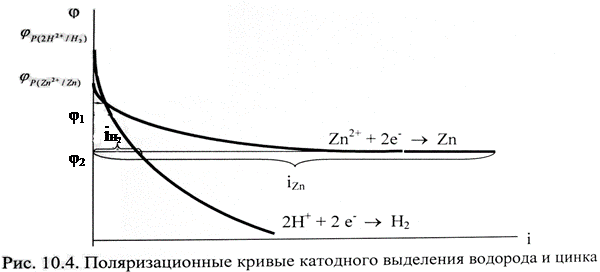
· поляризация процесса восстановления водорода больше поляризации разряда ионов металлов этой группы (или по-другому, выделение водорода на катоде происходит с более высоким перенапряжением по сравнению с перенапряжением разряда многих ионов металлов этой группы); пример: поляризационные кривые катодного выделения водорода и цинка (рис. 10.4).
Как видно из данного рисунка, равновесный потенциал цинкового электрода меньше потенциала водородного электрода, при малых плотностях тока на катоде выделяется лишь водород. Но водородное перенапряжение электрода больше, чем перенапряжение цинкового электрода, поэтому при повышении плотности тока начинает выделяться на электроде и цинк. При потенциале φ1 плотности токов выделения водорода и цинка одинаковы, а при потенциале φ2 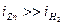 , т.е. на электроде выделяется в основном цинк.
, т.е. на электроде выделяется в основном цинк.
2. 
Анодные процессы.
2.1. На аноде в первую очередь идут процессы, характеризуемые наименьшим электродным потенциалом, т.е. в первую очередь окисляются сильные восстановители.
2.2. Обычно аноды подразделяют на инертные (нерастворимые) и активные (растворимые). Первые изготовляют из угля, графита, титана, платиновых металлов, имеющих значительный положительный электродный потенциал или покрытых устойчивой защитной плёнкой, служащих только проводниками электронов. Вторые – из металлов, ионы которых присутствуют в растворе электролита – из меди, цинка, серебра, никеля и др.
2.3. На инертном аноде при электролизе водных растворов щелочей, кислородосодержащих кислот и их солей, а также НF и ее солей (фторидов) происходит электрохимическое окисление гидроксид-ионов с выделением кислорода. В зависимости от рН раствора этот процесс протекает по- разному и может быть записан различными уравнениями:
а) в кислой и нейтральной среде
2 Н2О – 4еˉ = О2 + 4 Н+;
б) в щелочной среде
4ОН  – 4еˉ = О2 + 2Н2О.
– 4еˉ = О2 + 2Н2О.
Потенциал окисления гидроксид-ионов (потенциал кислородного электрода) рассчитывается по уравнению (см. раздел 10.3):
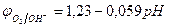 .
.
Кислородосодержащие анионы SO 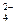 , SO
, SO 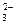 , NO
, NO 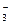 , CO
, CO 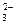 , PO
, PO 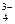 и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO
и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO 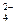 - 2eˉ = S2O
- 2eˉ = S2O 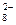
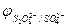 = 2,01 В.
= 2,01 В.
2.4. При электролизе водных растворов бескислородных кислот и их солей (кроме НF и ее солей) у инертного анода разряжаются их анионы.
Отметим, что выделение хлора (Cl2) при электролизе раствора НCl и её солей, выделение брома (Br2) при электролизе раствора HBr и её солей противоречит взаимному положению систем.
2Cl  - 2eˉ = Cl2
- 2eˉ = Cl2 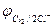 = 1,356 В
= 1,356 В
2Br  - 2eˉ = Br2
- 2eˉ = Br2 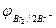 = 1,087 В
= 1,087 В
2H2O - 4eˉ = O2 + 4 Н+ 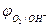 = 0,82 В (рН = 7)
= 0,82 В (рН = 7)
 Эта аномалия связана с анодной поляризацией процессов (рис. 10.5). Как видно, равновесный потенциал кислородного электрода (потенциал окисления гидроксид-ионов из воды) меньше равновесного потенциала хлорного электрода (потенциала окисления хлорид-ионов). Поэтому при малых плотностях тока выделяется лишь кислород. Однако выделение кислорода протекает с более высокой поляризацией, чем выделение хлора, поэтому при потенциале
Эта аномалия связана с анодной поляризацией процессов (рис. 10.5). Как видно, равновесный потенциал кислородного электрода (потенциал окисления гидроксид-ионов из воды) меньше равновесного потенциала хлорного электрода (потенциала окисления хлорид-ионов). Поэтому при малых плотностях тока выделяется лишь кислород. Однако выделение кислорода протекает с более высокой поляризацией, чем выделение хлора, поэтому при потенциале 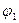 токи на выделение хлора и кислорода сравниваются, а при потенциале
токи на выделение хлора и кислорода сравниваются, а при потенциале 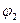 (высокая плотность тока) выделяется в основном хлор.
(высокая плотность тока) выделяется в основном хлор.
Если потенциал металлического анода меньше, чем потенциал ионов ОН  или других веществ, присутствующих в растворе или на электроде, то протекает электролиз с активным анодом. Активный анод окисляется, растворяясь: Ме – neˉ ® Men+.
или других веществ, присутствующих в растворе или на электроде, то протекает электролиз с активным анодом. Активный анод окисляется, растворяясь: Ме – neˉ ® Men+.
Выход по току. Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (Bj), называется выходом по току этого вещества:
(Bj) % = (Qj/Q) . 100,
где Qj – количество электричества, израсходованное на превращение j-го вещества; Q – общее количество электричества, прошедшее через электрод.
Например, из рис. 10.4 следует, что выход по току цинка растет с увеличением катодной поляризации. Для данного примера высокое водородное перенапряжение – явление положительное. Вследствие этого из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кобальт, никель и другие металлы.
Закон Фарадея. Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея, согласно которому масса электролита, подвергшаяся химическому превращению, а также масса веществ, выделившихся на электродах, прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ: m = MэIt/F,
где m – масса электролита, подвергшаяся химическому превращению,
или масса веществ – продуктов электролиза, выделившихся на электродах, г; Mэ – молярная масса эквивалента вещества, г/моль; I – сила тока, А; t – продолжительность электролиза, с; F – число Фарадея – 96480 Кл/моль.
Пример 1. Как протекает электролиз водного раствора сульфата натрия с угольным (инертным) анодом?
Решение.
Na2SO4 = 2Na+ + SO 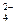
H2O D H+ + OH 
| (-) K | A (+) | |
| Na+, H2O (H+) | SO42-, H2O (OH  ) ) | |
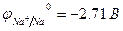 | 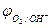 = 0,82B = 0,82B | |
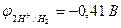 | 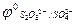 = 2,01B = 2,01B | |
2| 2H2O + 2eˉ= H2 + 2OH  | 2H2O – 4eˉ = O2 + 4H+ |
Суммарное уравнение:
6Н2О = 2Н2 + О2 + 4ОН  + 4Н+
+ 4Н+
или в молекулярной форме
6Н2О + 2Na2SO4 = 2Н2 + О2 + 4NaОН + 2Н2SO4.
В прикатодном пространстве накапливаются ионы Na+ и ионы ОН-, т.е. образуется щелочь, а около анода среда становится кислой за счёт образования серной кислоты. Если катодное и анодное пространство не разделены перегородкой, то ионы Н+ и ОН  образуют воду, и уравнение примет вид
образуют воду, и уравнение примет вид
2Н2О = 2Н2 + О2.
Итак, электролиз водного раствора сульфата натрия сводится к электролизу воды, а растворённая соль остаётся неизменной.
Пример 2. Как протекает электролиз водного раствора хлорида меди (II) CuCl2 с угольным анодом?
Решение.
CuCl2 = Cu2+ + 2Cl 
H2O D H+ + OH  .
.
| (-) K | А (+) | |
| Cu2+, H2O (H+) | Cl  , H2O (ОH , H2O (ОH  ) ) | |
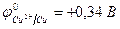 | 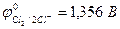 | |
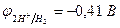 | 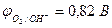 | |
| из-за анодной поляризации при высоких i протекает процесс: | ||
| Cu2+ + 2e– = Сu | 2Cl  - 2e– = Сl2 - 2e– = Сl2 |
Суммарное уравнение:
Cu2+ + 2Cl  = Cu + Cl2
= Cu + Cl2
или в молекулярной форме: CuCl2 = Cu + Cl2.
Пример 3. Как протекает процесс электролиза раствора сульфата цинка с инертным анодом?
Решение.
ZnSO4 = Zn2+ + SO 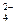
H2O D H+ + OH 
| (-) K | (+) A | |
| Zn2+, H2O (H+) | SO42-, H2O (OH-) | |
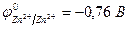 | 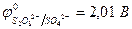 | |
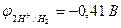 | 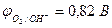 | |
| Из-за катодной поляризации протекают два процесса: | ||
| Zn2+ + 2e– = Zn | 2Н2О - 4е– = О2 + 4Н+ | |
2Н2О +2е– = Н2 + 2ОН  |
Суммарное уравнение реакции:
Zn2+ + 2H2O = Zn + H2 + O2 + 2H+
или в молекулярном виде
ZnSO4 + 2H2O = Zn + H2 + O2 + H2SO4
Пример 4. Как протекает электролиз водного раствора сульфата меди (II) с активным анодом?
Решение.
CuSO4 = Cu2+ + SO 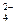
H2O D H+ + OH 
| (-) K | А (Cu) (+) | |
| Cu2+, H2O (H+) | SO 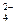 , H2O (ОH , H2O (ОH  ) ) | |
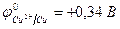 | 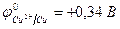 | |
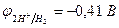 | 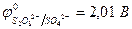 | |
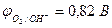 | ||
| Сu2+ + 2e– = Сu | Cu - 2e– = Сu2+ |
Суммарное уравнение:
Cu2+ + Cu = Cu + Cu2+
или в молекулярном виде
CuSO4 + Cu = Cu + CuSO4.
Концентрация CuSO4 в растворе при этом останется постоянной. Этот процесс применяется для электролитической очистки меди (электролитическое рафинирование).
Пример 5. Как протекает электролиз водного раствора хлорида цинка с активным анодом?
Решение.
ZnCl2 = Zn2+ + 2Cl 
H2O D H+ + OH-
| (-) K | A (Zn) (+) | |
| Zn2+, H2O(H+) | Cl  , H2O (OH , H2O (OH  ) ) | |
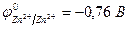 | 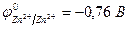 | |
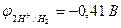 | 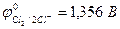 | |
| Из-за катодной поляризации | 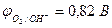 | |
| будут протекать два процесса: | ||
| Zn2+ + 2e– = Zn | Zn – 2e– = Zn2+ | 2 | |
2Н2О +2е– =Н2+ 2ОН  |
Суммарное уравнение:
Zn + 2H2O = H2 + Zn2+ + 2OH-
или в молекулярной форме
Zn + 2H2O = H2 + Zn(OH)2 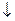 .
.
Пример 6. Определите массу цинка, которая выделится на катоде при электролизе раствора сульфата цинка в течение 1 часа при токе 26,8А, если выход цинка по току равен 50%.
Решение. В соответствии с законом Фарадея определим массу цинка, который выделился бы, если бы на катоде протекал один процесс:
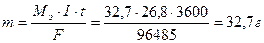
Выход цинка по току равен
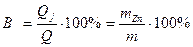
Отсюда масса выделившегося цинка составляет:
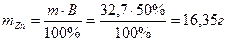
Применение электролиза.Практически нет ни одной отрасли техники, где бы он не применялся. В энергетике водород, полученный электролизом, используют для охлаждения генераторов на тепловых и атомных ЭС. Электролизом солей получают различные металлы: Cu, Zn, Cd, Ni, Mn и др. металлы. Электролиз используется для нанесения металлических покрытий на металлы и пластмассы (гальванические покрытия). Электролизом воды получают O2, H2, Cl2 и щёлочи из раствора хлорида натрия. Электролиз используют для зарядки аккумуляторов (см. раздел 10.2).
Коррозия металлов
Коррозия металлов – это процесс их самопроизвольного разрушения при взаимодействии с окружающей средой.
Ежегодно из-за коррозии теряются огромные количества металла. По ориентировочным данным от 5 до 30% получаемых чёрных металлов разрушается в результате коррозии. Однако во многих случаях косвенные убытки от коррозии могут значительно превышать прямые потери за счёт растворения металла. Это и выход из строя металлических конструкций, сложных приборов и аппаратуры, простой оборудования, утечки нефти и газа из прокорродировавших трубопроводов, сопровождаемые при этом нанесением природе невосполнимого экологического ущерба. Поэтому изучение причин, вызывающих коррозию, установление влияния различных факторов на скорость коррозии имеют своей практической целью защиту металлов и сплавов от коррозионного разрушения при их обработке и эксплуатации.
Механизм коррозии. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. В процессе химической коррозии происходит прямое гетерогенное взаимодействие металлов с окислителем окружающей среды, в результате которого между ними совершается обмен электронами, т.е. протекает обычная ОВР. Примером может служить окисление металлов кислородом воздуха при высоких температурах: Me + O2 ® MeO.
Электрохимическая коррозия возникает при контакте металлов с электролитами (во влажном воздухе, в почве, в растворах электролитов и т.п.) и является результатом протекания сопряжённых электродных процессов в образующихся короткозамкнутых гальванических элементах.
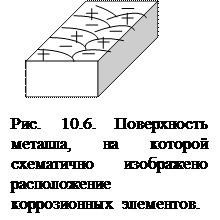 Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии двигаются внутри металла от анодных участков к катодным, т.е. образуются короткозамкнутые гальванические элементы, в которых анодные и катодные участки замкнуты накоротко через сам металл.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии двигаются внутри металла от анодных участков к катодным, т.е. образуются короткозамкнутые гальванические элементы, в которых анодные и катодные участки замкнуты накоротко через сам металл.
Отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходит анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими элементами (имеющими размеры, хорошо различимые невооружённым глазом) и микрогальваническими (обнаруживаемыми лишь при помощи микроскопа), т.е. явлются коррозионными элементами. Обычно поверхность корродирующего металла представляет собой многоэлектродный коррозионный элемент (чередование катодных и анодных участков – рис. 10.6). В первом приближении эту поверхность можно считать как двухэлектродную систему, т.е. состоящую из участков двух видов: анодных и катодных. Коррозионный элемент (короткозамкнутый гальванический элемент) схематично можно изобразить:
(–) А | коррозионная среда | К (+)
При работе коррозионных элементов, т.е. при электрохимической коррозии имеют место три основных процесса (рис. 10.7):
|
Me(K) – neˉ ® Men+(p)
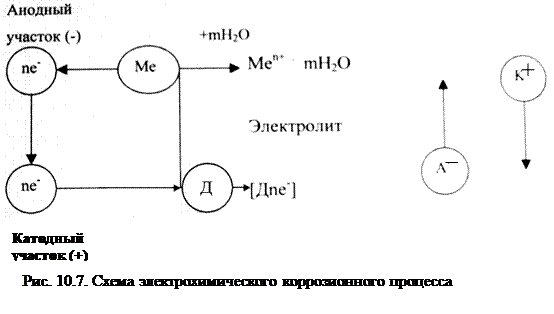
2. Процесс перетекания электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов и анионов в растворе.
3. Катодный процесс – приём электронов каким – либо окислителем окружающей коррозионной среды (какими – либо ионами или молекулами – деполяризаторами) на границе раздела фаз металл -коррозионная среда:
Ох + neˉ ® Red или Д + neˉ ® [Дneˉ].
