Пример 9. Схема электролиза расплава хлорида меди (II)
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации расплава соли | CuCl2 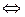 Cu2+ + 2Cl- Cu2+ + 2Cl- |
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | Ионы меди в расплаве восстанавливаются. На аноде в расплаве ионы хлора окисляются |
| 3. | составить схемы процессов восстановления и окисления | К- : Cu2+ + 2 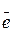 = Cu0 А+ : 2Cl- - 2 = Cu0 А+ : 2Cl- - 2 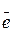 = Cl20 = Cl20 |
| 4. | составить уравнение электролиза расплава соли | CuCl2 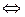 Cu0 + Cl20 Cu0 + Cl20 |
пример 10. схема электролиза расплава сульфата натрия.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации расплава соли | Na2SO4 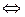 2Na+ + SO42- 2Na+ + SO42- |
| 2. | составить схемы процессов восстановления и окисления | К- : Na+ + 1 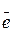 = Na0 А+ : 2 = Na0 А+ : 2 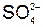 = = 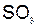 + 2 + 2 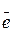 + + 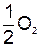 , , |
| 3. | составить уравнение электролиза расплава соли | 2Na2SO4  4Na +2 4Na +2 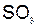 + + 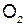 |
Законы электролиза
Первый закон Фарадея.
Масса вещества, выделившегося на электроде при прохождении по раствору электролита электрического тока, прямо пропорциональна количеству пропущенного электричества.
m=k·Q
где m- масса выделившегося вещества, k – коэффициент пропорциональности, называемый электрохимической эквивалентной массой, Q – количество электричества, выраженное в единицах заряда (Кл = А·ч, либо в А·ч).
Поскольку количества электричества Q это произведение силы электрического тока (А) на время t затраченного на электролиз (с), т.е. 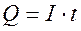 , то первый закон Фарадея можно представить в виде:
, то первый закон Фарадея можно представить в виде:

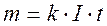
Количественной мерой электрического заряда является единица «Фарадей». Фарадей – это заряд, который несет на себе один моль электронов или один моль однозарядных ионов,
1F = 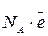 = 6.02·1023·1.6·10-19
= 6.02·1023·1.6·10-19 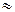 96500 Кл = 26,8 А·ч
96500 Кл = 26,8 А·ч
1F=96500 Кл = 26,8 А·ч
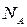 - число Авогадро,
- число Авогадро, 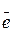 - заряд электрона.
- заряд электрона.
Если через раствор пропустить 1 Фарадей электричества (96500 Кл), то на электроде выделится 1 моль-эквивалент вещества.
2. второй закон Фарадея:
Согласно второму закону Фарадея, при определённом количестве прошедшего электричества отношения масс прореагировавших веществ равно отношению их химических эквивалентов.
Химический эквивалент элемента, равен отношению части массы элемента, которая присоединяет или замещает в химических соединениях одну атомную массу водорода или половину атомной массы кислорода, к 1/12 массы атома С12.
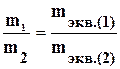 ,
,
где m1 – масса вещества (1) образовавшегося или подвергнутого превращению вещества: mэкв1.- его эквивалентная масса; m2 – масса вещества (2) образовавшегося , mэкв2.- его эквивалентная масса;
3. Объединенный закон Фарадея:
Масса электролита, подвергшаяся превращению при электролизе, а также масса образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через электролит, и эквивалентным массам соответствующих веществ.
Этот закон выражается следующим уравнением: 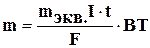
где m – масса образовавшегося или подвергнутого превращению вещества: mэкв.- его эквивалентная масса; I – сила тока, t - время в секундах, F = 96500 кл – число Фарадея, (или t - время в часах, то F = 26,8 А·ч); ВТ – выход по току.
Или при вычислении объемов выделившихся газов: 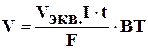
V – объем выделившегося газа (л);Vэкв.- эквивалентный объем (л/моль). Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль.
