Соединения р-элементов IV группы
Карбонат гидроксомеди (II) (CuOH)2СО3
Меры предосторожности. Какие меры предосторожности необходимо соблюдать при проведении реакций, в результате которых выделяется газ? Какова первая помощь при термических ожогах?
Методика синтеза.Синтез рассчитан на получение 3¸4 г карбоната гидроксомеди (II) взаимодействием сульфата меди и гидрокарбоната натрия в водном горячем растворе (1).
Медный купорос и гидрокарбонат натрия тонко измельчают по отдельности, тщательно смешивают и еще раз тщательно измельчают (2). Следует учесть, что гидрокарбонат следует брать с 10%-ным избытком по отношению к уравнению реакции. Полученную смесь медленно (3) при непрерывном перемешивании (4)вносят в горячую, но не кипящую воду (5), которую берут из расчета 2 дм3 воды на 1 моль сульфата меди. После добавления последней порции смеси твердых веществ образовавшуюся суспензию выдерживают при нагревании и перемешивании 10¸15 минут. По окончании реакции (6)осадку дают отстояться, затем промывают его водой методом декантации до удаления сульфат-иона (проверка – проба с раствором хлорида бария, подкисленным соляной кислотой)(7). Промытый осадок взмучивают с 20 см3 воды, добавляют несколько капель раствора аммиака (8), дают отстояться, жидкость декантируют, осадок промывают 2¸3 раза горячей водой, затем отделяют от жидкости фильтрованием под вакуумом или при помощи центрифуги. Препарат рекомендуется сушить сначала между листами фильтровальной бумаги, а затем при температуре 90°С до постоянной массы (9).
Исследование свойств полученного вещества.
1)Предложите способ определения наличия в полученном веществе карбонат-ионов и ионов меди (II) (10).
2)Испытайте отношение вещества к:
- нагреванию;
- действию кислот;
- действию раствора щелочи
- небольшого количества и избытка концентрированного раствора аммиака.
Опишите и объясните наблюдаемые эффекты. Напишите уравнения соответствующих реакций.
3) Прокалите тигель до постоянной массы (масса а), поместите в него примерно 0,3-0,5 г полученного вещества, взвесьте тигель с веществом (масса b). Точную массу вещества вычисляют по разности (b - а). Тигель с веществом нагрейте в пламени спиртовки или в муфельной печи до полного разложения соли (11). Для нагревания тигля используйте штатив с кольцом и фарфоровый треугольник, а также тигельные щипцы. По окончании реакции охладите тигель в эксикаторе, взвесьте, снова прокалите в пламени спиртовки и охладите в эксикаторе. Если масса тигля с содержимым после повторного прокаливания не изменилась, по результатам измерений вычислите массовую долю CuO в малахите и сравните ее с вычисленной по формуле соли.
4) Соберите прибор, изображенный на рис. 3.4
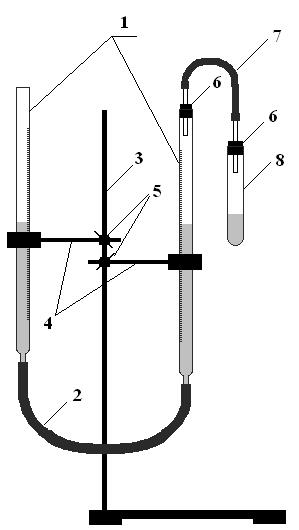 Рис. 3.4
Рис. 3.4
Прибор для измерения объема газа, выделившегося в ходе химической реакции.
Бюретки, 2- соединительный шланг, 3- штатив, 4 – лапки, 5 – муфты, 6 – резиновые пробки, 7 - соединительный шланг со стеклянными трубками на концах, 8 – пробирка для проведения реакции
Сообщающиеся бюретки заполните насыщенным раствором хлорида натрия (чтобы уменьшить растворимость углекислого газа в воде) примерно до половины высоты бюреток.
Перед началом работы прибор необходимо проверить на герметичность. Для этого подсоедините к одной из бюреток пустую пробирку (резиновые пробки можно для лучшего прилегания к стеклу смочить водой) и, перемещая одну из бюреток по штативу, создайте разницу в уровнях жидкости в бюретках 8-10 см. Если в течение 10 минут жидкость в бюретках останется на этом же уровне, прибор является герметичным.
В этом случае в пробирку, использованную для проверки прибора на герметичность, налейте примерно на 1/3 соляную кислоту (w = 20%). Взвесьте примерно 0,1 г карбоната гидроксомеди, неплотно заверните в папиросную или фильтровальную бумагу, смочите водой, поместите ее в пробирку с кислотой, прижав с стенке сосуда. Пакетик с солью не должен соприкасаться с кислотой! Подсоедините пробирку к одной из бюреток, как показано на рисунке, перемещая бюретки по штативу, установите уровни жидкости в них на одной высоте. Запишите в протокол, на каких делениях находится жидкость в каждой из бюреток (отсчет проводите по нижнему краю мениска). Затем наклоните пробирку так, чтобы навеска соли оказалась в кислоте. После окончания выделения газа прибор не разбирайте, дайте содержимому пробирки остыть до комнатной температуры и снова, перемещая бюретки вертикально по штативу, снова установите уровни жидкости в них на одной высоте и запишите в протокол, на каких делениях находится жидкость в каждой из бюреток. По разнице показаний уровней жидкости до и после проведения реакции вычислите объем выделившегося газа. Измерьте атмосферное давление (при помощи барометра) и температуру в лаборатории. По закону сообщающихся сосудов, давление газов в той бюретке, которая не сообщается с атмосферой, равно атмосферному. Чтобы вычислить парциальное давление собственно СО2, от значения атмосферного давления следует вычесть давление насыщенного водяного пара при комнатной температуре (см. справочник). Далее, используя уравнение Менделеева-Клапейрона, вычислите количество вещества образовавшегося углекислого газа и его массу. На основании экспериментальных данных вычислите массовую долю СО2 в навеске соли и сравните ее с вычисленной по формуле карбоната гидроксомеди.
Вопросы для допуска
(1) Укажите тип реакции, лежащей в основе данного синтеза.
(2) Для чего требуется измельчение веществ?
(3)Почему смесь солей нужно вносить в горячую воду частями, медленно?
(4)Почему требуется непрерывное перемешивание?
(5)Какие побочные процессы могут протекать при использовании в работе кипящей воды? Что должно наблюдаться при этом?
(6)По какому признаку можно судить об окончании реакции?
(7)Запишите уравнение этой реакции в молекулярной и ионно-молекулярной формах. Объясните, почему в данном случае раствор хлорида бария нужно подкислять. Что должно наблюдаться в случае присутствия сульфат-ионов? В случае их отсутствия?
(8)Что при этом может произойти, если в осадке присутствует примесь гидроксида меди? Напишите уравнение реакции.
(9)Почему рекомендуются такие условия сушки?
(10)Какиекачественные реакции на карбонат-ионы и ионы меди (II) можно использовать? Запишите уравнения этих реакций и предложите последовательность их проведения.
(11)Как проверить полноту разложения соли?
Вопросы и задания для обсуждения
1. Вычислите значения констант гидролиза для карбоната и гидрокарбоната натрия. Объясните различие рН растворов карбоната натрия и гидрокарбоната натрия.
2. Вычислите значение рН 0,1М раствора: а) гидрокарбоната натрия; б) карбоната натрия, в) гидроксида натрия.
3. Можно ли в данном синтезе заменить гидрокарбонат натрия гидрокарбонатом калия? Ответ мотивируйте.
4. Можно ли в данном синтезе заменить гидрокарбонат натрия карбонатом? Почему?
5. Можно ли заменить гидрокарбонат натрия щелочью? Почему?
6. Напишитеструктурные формулы молекулы угольной кислоты и карбонат-иона и оцените их пространственную конфигурацию.
7. Вычислите энтальпии разложения карбонатов магния, кальция, стронция и бария. На основании вычислений сделайте вывод о термической устойчивости этих соединений.
8. Приведите примеры реакций термического разложения кислых, средних и основных карбонатов.
9. Чем объясняется тот факт, что карбонаты щелочных металлов, кроме лития, плавятся без разложения?
10. Приведите уравнения реакций, характеризующих кислотно-основные и окислительно-восстановительные свойства углекислого газа.
11. Карбонат гидроксомеди составляет основу природного минерала малахита. В результате каких природных процессов может разрушиться этот минерал? Запишите уравнения реакций.
12. Запишите уравнения реакций, являющихся качественными а) на карбонат-ион, б) углекислый газ.
13. Запишите уравнения реакций взаимодействия водных растворов следующих солей, сливаемых попарно: а) карбонат натрия и хлорид кальция; б) карбонат калия и сульфат алюминия; в) карбонат цезия и хлорид железа (III). Объясните на этих примерах, в каих случаях при смешивании водных растворов солей можно ожидать протекания реации совместного гидролиза, а в каких этот процесс принципиально невозможен.
Карбонат кобальта (II) CoCO3
Меры предосторожности. Какие меры предосторожности необходимо соблюдать при работе с газами?
Методика синтеза. Для получения 1¸1,5 г карбоната кобальта готовят насыщенные при 0°С растворы соли кобальта (II) и растворимого гидрокарбоната (1). Можно использовать CoCl2×6H2O и гидрокарбонат натрия или калия. Гидрокарбонат берут с 20%-ным избытком относительно стехиометрического количества.
Приготовленный раствор гидрокарбоната насыщают углекислым газом (2) и при постоянном перемешивании, порциями (3), приливают к раствору соли кобальта, находящемуся в колбе. После смешивания растворов колбу закрывают пробкой с вставленной в нее клапаном Бунзена (4) и продолжают перемешивание реакционной смеси еще 15-20 мин, до полного осаждения ионов Со2+ (5).
Образовавшийся осадок отделяют от маточного раствора (6), промывают водой до нейтральной реакции (7), затем этиловым спиртом сушат при 35-40 оС (8).
