Классификация электродов
Электроды классифицируют по химической природе веществ, участвующих в электродном процессе.
В электродах первого рода восстановленной формой является металл электрода, а окисленной формой – ионы этого металла. Как правило, электроды первого рода обратимы по катиону (т.е. их потенциал является функцией активности катиона). Примерами электрода первого рода являются электроды элемента Даниэля-Якоби:
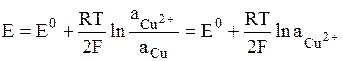 ,
,
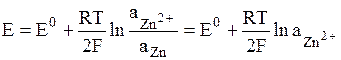 .
.
Если в электродных процессах участвуют чистые твердые или жидкие вещества, то их активности равны единице.
Общее уравнение для электродов I рода имеет вид:
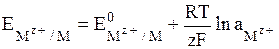 . (7)
. (7)
К электродам первого рода относятся амальгамные электроды, в которых восстановленной формой является – сплав металла с ртутью (элемент Вестона) Cd2+ + 2e = Cd(Hg):
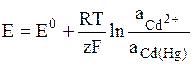 .
.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор, содержащий анионы этой соли. Окисленной формой является труднорастворимая соль, а восстановленной – металл и анион соли. Электроды второго рода обратимы по аниону (т.е. их потенциал является функцией активности аниона). Примерами электродов второго рода являются следующие широко распространенные электроды сравнения:
- хлоридсеребряный электрод (обозначается Ag│AgCl│Cl-);
электродная реакция AgCl + e = Ag + Cl-,
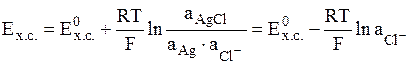 .
.
- каломельный электрод (обозначается Hg│Hg2Cl2│Cl-);
электродная реакция Hg2Cl2 + 2e = 2Hg + 2Cl-,
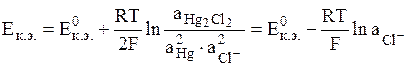
Общий вид уравнения Нернста для электродов II рода:
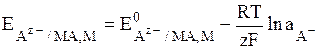 (8)
(8)
Окислительно-восстановительные, или редокс-электроды состоят из инертного металла, который не участвует в реакции, а является переносчиком электронов между окисленной и восстановленной формами вещества.
Одним из лучших материалов для реализации окислительно-восстановительного равновесия является платина, в качестве же реагента можно взять, например, хингидрон. Это эквимолярная смесь хинона С6Н402 и гидрохинона С6Н4(ОН)2, между которыми в водном растворе в присутствии платины устанавливается электрохимическое равновесие:
С6Н4О2 +2 Н30+ + 2е = С6Н4(ОН)2 + 2 Н2О.
Потенциал, устанавливающийся на Pt-электроде при рН < 8.5, определяется лишь активностью ионов гидроксония:
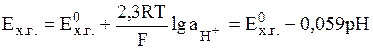 (9)
(9)
поскольку активности хинона и гидрохинона примерно равны, а активность воды близка к единице. Стандартный потенциал хингидронного электрода Е0хг при 298 К составляет 0,699 В.
К окислительно-восстановительным электродам относятся газовые электроды. Газовый электрод состоит из инертного металла, к которому попадает газ, участвующий в электродном процессе. Восстановленной формой является газ, а окисленной – ионы в растворе. Наиболее известным примером газового электрода является водородный электрод. Его записывают в виде: Pt│H2│H+; электродная реакция: 2Н+ + 2е = Н2; уравнение для определения потенциала:
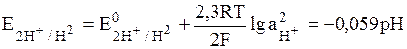 (10)
(10)
Если два раствора разделены физической границей конечной толщины, обладающей избирательной пропускной способностью по отношению к частицам различного сорта, то такая граница является мембраной. На основе полупроницаемых мембран, обладающих повышенной избирательностью к определенным ионам, созданы ионселективные электроды. С определенным допущением к ионселективным электродам с твердой мембраной относят стеклянный электрод, селективный по отношению к ионам Н3О+. Как показывает теоретический анализ, если рН < 12, то потенциал стеклянного электрода описывается формулой:
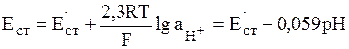 (11)
(11)
В этом выражении Е'ст является константой для данного электрода, т.к. зависит от сорта стекла, типа электрода сравнения и ряда иных факторов.
Хингидронный, водородный и стеклянный электроды часто применяют для определения рН растворов.
Примеры решения задач
Пример 1.
Вычислить электродный потенциал медного электрода в растворе, содержащем 1,6 г CuSO4 в 200 мл раствора при 298 К. Кажущаяся степень диссоциации соли в растворе равна 0,4.
Решение:
Находим молярную концентрация CuSO4.
с(CuSO4) = ν(CuSO4) / Vр-ра = m(CuSO4) / M(CuSO4)∙Vр-ра = = 1,6г / 160г/моль∙0,2л = 0,05моль/л.
Концентрация потенциалопределяющих ионов Cu2+ будет равна:
c(Сu2+) = α∙ с(CuSO4) =0,4∙0,05моль/л = 0,02моль/л.
Из справочника находим значение стандартного электродного потенциала: Е0(Cu2+/Cu) = 0,34В. По уравнению Нернста рассчитываем электродный потенциал:
Е(Cu2+/Cu) =0,34В + 2,3∙8,31(Дж/мольК)∙298К∙lg0,02моль/л / 2∙96500Кл/моль = 0,37 В.
Ответ: 0,37 В.
Пример 2.
Вычислить ЭДС медно-цинкового элемента при 298К, в котором концентрация ионов меди 0,0002 моль/л, а ионов цинка – 0,5 моль/л, gCu2+ = 1, gZn2+ = 0,4.
Решение:
Вычисляем ЭДС
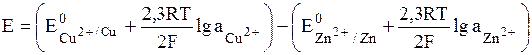 , где аi » Сi∙gi.
, где аi » Сi∙gi.
Значения стандартных электродных потенциалов находим в справочнике: Е0(Cu2+/Cu) = 0,34В; Е0(Zn2+/Zn) = -0,76В, отсюда:
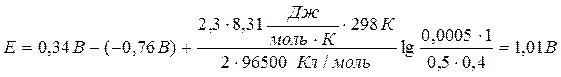
Ответ: 1,01В.
Пример 3.
При 298К ЭДС гальванического элемента, составленного из нормального водородного электрода и хингидронного электрода, приготовленного на основе исследуемого раствора, равна 0,2864В. Вычислить рН исследуемого раствора.
Решение:
По уравнению (1.28) для Т = 298 К имеем:
рН = (Е0х.г – Ех.г) / 0,059 = (0,6994В – 0,2864В) / 0,059 = 7.
Значение Е0х.г. = 0,6994 В взято из справочника.
Ответ: 7.
