Тепловые эффекты. закон гесса
Раздел химической термодинамики, который изучает тепловые эффекты химических реакций и фазовых переходов, называется термохимией.
Обычно химические реакции проводят при V = const или Р = const. Если V = const, то Qv = ∆Uv,
если Р = const, то Qp = ∆Up – p∆V,
таким образом, при V или Р = const теплота процесса приобретает свойства функции состояния, т.е. не зависит от пути процесса.
Qp и Qv называют изобарным и изохорным тепловыми эффектами реакций.
Независимость теплового эффекта процесса от пути его протекания была установлена опытным путем русским ученым Г.И. Гессом в 1836 г.
Тепловой эффект процесса не зависит от промежуточных стадий, а определяется начальным и конечным состояниями системы.
Математическое выражение закона Гесса:
Qv = ∆U; Ор = ∆Н
Представим себе процесс превращения исходных веществ в продукты реакции различными путями:
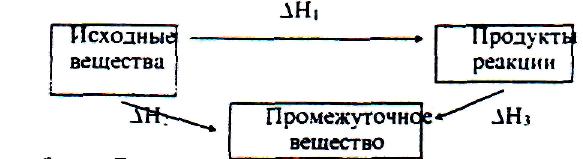
Закон Гесса утверждает, что указанные тепловые эффекты связаны между собой соотношением
∆H1 = ∆H2 + ∆H3
В термохимии используют термохимические уравнения реакций. Термохимическими называют такие уравнения, в которых приведены тепловые эффекты. Тепловой эффект реакции зависит от природы реагирующих веществ и их агрегатных состояний, поэтому а термохимических уравнениях символами (г. ж. т) обозначают состояния веществ. Например,
H2(г) + ½О2(г) = Н2О(ж) – 284,2 кДж/моль
Применяя закон Гесса. можно определять тепловые эффекты реакций, которые экспериментально определить нельзя.
Рассмотрим пример определения теплоты гидратообразования сульфата меди (II) CuSО45H2О
CuSО4 + 5H2О = CuSО45H2O.
Теплотой гидратообразования называют теплоту, выделяемую при присоединении к 1 моль твердой безводной соли кристаллизационной воды до образования устойчивого кристаллогидрата.
Экспериментальное определение теплоты образования CuSO45Н2О затруднительно, т.к. одновременно образуются кристаллогидраты различного состава.
(∆Hm)1
CuSO4 Cu2+SO42- (раствор)
(∆Hm)3 (∆Нm)2
CuSO45H2O
Гидратированные ионы Cu2+ и SO42- можно получить двумя путями:
1) растворением CuSO4 и
2) растворением CuSO4 через образование кристаллогидрата.
Исходя из закона Гесса:
(∆Нm)1 = (∆Нm)2 + (∆Нm)3
где (∆Нm)1, (∆Нm)2, (∆Нm)З – соответственно интегральные теплоты растворения CuSO4, CuSO45Н2О и теплота гидратообразования. Тогда теплота гидратообразования:
(∆Нm)3 = (∆Нm)1 – (∆Нm)2
Интегральной теплотой растворения (∆Нm) называют изменение энтальпии при растворении 1 моль вещества в некотором количестве чистого растворителя.
Закон Гесса позволяет также определять теплоты нейтрализации сильных кислот и сильных оснований.
Теплотой нейтрализации называют тепловой эффект реакции образования 1 моль жидкой воды из ионов водорода и гидроксила:
Н+ + ОН- = Н2О + Q1
Для того, чтобы можно было сопоставлять тепловые эффекты различных реакций и проводить термохимические расчеты, введено понятие теплового эффекта при стандартных условиях.
Под стандартным тепловым эффектом понимают его величину при давлении 1.01.105Па и температуре ТºК. В настоящее время термохимические исследования чаше всего проводят при 25°С. В справочных таблицах тепловые эффекты приводят при Т = 298ºК и записывают стандартный тепловой эффект – ∆Н°298.
Из закона Гесса вытекает несколько следствий, два из которых применяются для расчета тепловых эффектов:
1). Тепловой эффект реакции равен алгебраической сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ с учетом стехиометрических коэффициентов:
∆Н°298 = Σvi∆Н°298 (прод) – Σvi∆H°(исх)
Теплотой образования называют то количество теплоты, которое выделяется или поглощается при образовании 1 моль вещества из простых веществ, взятых в устойчивом состоянии при рассматриваемых условиях (р,Т).
2). Тепловой эффект реакции равен алгебраической сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов.
∆Н298 = Σvi∆Hc298(исх) – Σvi∆Hc298(прод)
Теплота сгорания – количество теплоты, которое выделяется при полном сгорании 1 моль вещества до высших оксидов при данных условиях (р, Т).
ТЕПЛОЕМКОСТЬ
Средней теплоемкостью называется количество теплоты Q, поглощаемое при нагревании 1г или 1 моль вещества на t:
С = Q / ∆Т
Истинной теплоемкостью называют отношение бесконечно малого количества теплоты δQ. полученного телом, к соответствующему изменению его температуры:
C = δQ / dT
Процесс нагревания или охлаждения чаше проводят либо при Р = const, либо при V = const, тогда
Cv = δQv / dT; Cp = δQp / dT
Теплоемкости Ср и Cv отличаются на величину работы, необходимой для изменения объема системы:
Ср – Cv = R
Теплоемкости твердых, жидких и газообразных веществ повышаются с температурой:
Ср = f / (Т).
Однако эту зависимость нельзя определить на основании законов термодинамики, она изучается экспериментально. Обычно для расчетов применяется уравнение
Ср = а + вТ + с'Т-2 +...,
где а, в и с' – постоянные, которые для многих веществ могут быть найдены в справочнике.
Согласно закону Гесса можно вычислить тепловой эффект реакции при той температуре (обычно 298), при которой известны теплоты образования всех реагентов. Однако часто необходимо знать тепловой эффект реакции при различных температурах. Уравнение, дающее зависимость ∆Н от Т называется уравнением Кирхгоффа (интегральная форма):
298ʃT ∆H°T = 298ʃT ∆CpdT
∆H°Т = ∆H°298 + 298ʃT (∆а + ∆bТ + ∆сТ2 + ...) dT
∆Н° = ∆Н°298 + ∆а (Т – 298) + ∆b/2 (Т² – 2982) – ∆с' (1/Т – 1/298)
Расчеты тепловых эффектов реакции по уравнению Кирхгофа производят при составлении тепловых балансов процессов производства различных химических веществ, в том числе и лекарственных соединений.
