Основные классы неорганических соединений
Все вещества являются простыми или сложными. Простые вещества состоят из атомов одного и того же элемента, например металл железо – Fe, газ хлор Cl2, кислород О2 и т.д. По физическим и химическим свойствам простые вещества де-лятся на металлы и неметаллы.
Сложные вещества состоят из атомов нескольких элементов. Многоэлементные кислородосодержащие соединения по химическим свойствам разделяются на оксиды, основания, кислоты и соли:
 | основные | K2O, Na2O, MgO, CaO, BaO, SrO, CuO, FeO, CrO |
| Оксиды | кислотные | CO2, SO2, SO3, P2O5, N2O5, CrO3, Cl2O7, MnO3, Mn2O7 |
| амфотерные | BeO, ZnO, PbO, SnO, PbO2, MnO2, SnO2, Cr2O3, Fe2O3, | |
| Основания | KOH, NaOH, Mg(OH)2, Ca(OH)2, Ba(OH)2, Sr(OH)2, Cu(OH)2 | |
 | средние | KCl, Na2CO3, Ca(NO3)2, Ba3(PO4)2, LiClO4, Na2MnO4, Rb2S |
| Соли | кислые | NaHCO3, Al(HSO4)3, Ca(H2PO4)2, KHS, MgHPO4, K2HPO4 |
| основные | AlOHSO4, [Al(OH)2]2SO4, (CaOH)2CO3, MgOHCH3COO |
Основания и кислородосодержащие кислоты часто рассматриваются как гидраты оксидов и объединяются в единый класс гидроксидов, имеющих основный или кислотный характер.
Оксиды - соединения элемента с кислородом. По свойствам различают основные, кислотные и амфотерные оксиды. Основным оксидам соответствуют основания. Это оксиды большинства металлов обычно со степенью окисления +1, +2 и редко +3.
Химические свойства основных оксидов заключаются в следующем:
1) основные оксиды взаимодействуют с кислотами:
Основный оксид + кислота = соль + (вода)
СаO + 2HNO3 = Ca(NO3)2 + H2O
2) некоторые основные оксиды (прежде всего оксиды s-элементов, а также оксиды скандия, иттрия, лантана) непосредственно реагируют с водой:
Основный оксид + вода = основание
CaO + H2O = Ca(OH)2; Rb2O + H2O = 2RbOH
3) основные оксиды взаимодействуют с кислотными оксидами (чаще всего при сплавлении):
Основный оксид + кислотный оксид = соль
СаO + N2O5 = Ca(NO3)2; Na2O + CO2 = Na2CO3
Кислотным оксидам соответствуют кислоты. К ним относятся оксиды неметаллов (большинства р-элементов) со степенью окисления обычно +3, +4, +5, +6, +7, например, B2O3, CO2, P2O5, SO3, Cl2O7, а также некоторых металлов (d-элементов) с максимальной степенью окисления металла, например Ta2O5, MoO3, Mn2O7.
Химические свойства кислотных оксидов следующие:
1) многие кислотные оксиды с водой образуют кислоты, т.е.:
Кислотный оксид + вода = кислота
СO2 + H2O = H2CO3; P2O5 + 3H2O = 2H3PO4;
SO3 + H2O = H2SO4; 2CrO3 + H2O = H2Cr2O7
2) кислотные оксиды взаимодействуют с основаниями в водных растворах или при сплавлении:
Кислотный оксид + основание = соль + вода
СО2 + Са(ОН)2 = СаСО3↓ + Н2О; SiO2 + 2NaOH = Na2SiO3 + H2O
3) кислотный оксид + основный оксид = соль.
CO2 + CaO = CaCO3; P2O5 + 3BaO = Ba3(PO4)2; SO2 + K2O = K2SO3
Амфотерные оксиды –это оксиды некоторых элементов, которые в зави-симости от условий проявляют свойства как основных, так и кислотных оксидов, т.е. характеризуются ктислотно-основной двойственностью, например BeO, Al2O3, MnO2, ZnO, Cr2O3, PbO, SnO, PbO2, SnO2 и т.д. Такие соединения могут реагировать и с кислотами, и с кислотными оксидами, проявляя основные свой-ства:
BeO + 2HNO3 = Be(NO3)2 + H2O; BeO + CO2 = BeCO3 Они также могут реагировать и с основаниями, и основными оксидами. При этом они ведут себя как кислотные соединения:
BeO + 2NaOH = Na2BeO2 + H2O; BeO + Na2O + Na2BeO2.
Кислоты –это электролиты, которые в водных растворах диссоциируют на катионы водорода и анионы кислотного остатка. Кислоты бывают сильные (HCl, HBr, HNO3, H2SO4 и др.) и слабые (HNO2, H2CO3, H3PO4 и др.). Основность кислоты определяется числом ионов Н+, участвующих в реакции с основанием, и является переменной величиной, например:
НЗРО4 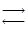 Н+ + Н2РО4-, основность кислоты равна 1;
Н+ + Н2РО4-, основность кислоты равна 1;
НЗРО4 + NaOH = NaН2РО4 + H2O
НЗРО4 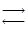 2Н+ + НРО42-, основность кислоты равна 2;
2Н+ + НРО42-, основность кислоты равна 2;
НЗРО4 + 2NaOH = Na2НРО4 + 2H2O
НЗРО4 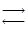 3Н+ + РО43-, основность кислоты равна 3;
3Н+ + РО43-, основность кислоты равна 3;
НЗРО4 + 3NaOH = Na3РО4 + 3H2O
В общем случае число кислотных остатков равно наибольшей основности кислоты. Величина заряда аниона кислотного остатка определяется числом ка-тионов водорода, образующихся при диссоциации. Важнейшие химические свойства кислот следующие:
1) кислота + основный оксид = соль + вода:
2HCl + FeO = FeCl2 + H2O
2) кислота + основание = соль + вода:
2HCl + Fe(OH)2 = FeCl2 + 2H2O
3) кислота + амфотерный оксид = соль + вода:
2HCl + BeO = BeCl2 + H2O
4) кислота + амфотерное основание = соль + вода:
2HCl + Be(OH)2 = BeCl2 + 2H2O
5) кислота + основная соль = средняя соль(или две средние соли)+ вода:
2HCl + (FeOH)Cl = FeCl2 + 2H2O
2HNO3 + 2(FeOH)Cl = FeCl2 + Fe(NO3)2 + 2H2O
6) многоосновная кислота + средняя соль этой кислоты = кислая соль:
H2SO4 + FeSO4 = Fe(HSO4)2
Основания – это электролиты, которые в водных растворах диссоциируют на гидроксид-ионы и катионы основного остатка, причем число образующихся ионов ОН- определяет кислотность основания, например:
Cа(OH)2 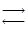 (CаOH)+ + OH-, кислотность равна 1;
(CаOH)+ + OH-, кислотность равна 1;
Cа(OH)2 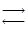 Cа2+ + 2OH-, кислотность равна 2.
Cа2+ + 2OH-, кислотность равна 2.
Важнейшие свойства оснований можно выразить следующими возможными процессами:
1) основание + кислотный оксид = соль + вода:
2NaOH + CO2 = Na2CO3 + H2O
2) основание + кислота = соль + вода:
2NaOH + H2CO3 = Na2CO3 + 2H2O
3) основание + амфотерный оксид = соль + вода:
2NaOH + BeO = Na2BeO2 + H2O
4) основание + амфотерное основание + соль + вода:
2NaOH + Be(OH)2 = Na2BeO2 + 2H2O
5) основание + кислая соль = средняя соль + вода:
NaOH + NaHCO3 = Na2CO3 + H2O
6) основание + средняя соль = новое основание + соль:
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
Амфотерные основания -это сложные вещества, которые обладают химическими свойствами основания и кислоты, т.е. как и амфотерные оксиды, характеризуются кислотно-основной двойственностью, и их можно представить в форме основания и кислоты:
Al(OH)3 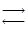 H3AlO3
H3AlO3
Отсюда и их поведение:
1) как основание – реагируют с сильными кислотами, растворяются в них:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2) как кислота – взаимодействуют со щелочами:
H3AlO3 + 3КОН = К3AlO3 + 3Н2О (при сплавлении)
или
Al(OH)3 + 3KOH = K3[Al(OH)6] (в водном растворе).
Соли– вещества ионного строения, которые в водных растворах диссоциируют на ионы основного и кислотного остатка:
Na2SO4  2Na+ + SO42-
2Na+ + SO42-
По составу различают следующие виды солей:
1) средние – продукты полной нейтрализации кислоты основанием, при этом происходит полное замещение атомов водорода в молекуле кислоты:
Сu(OH)2 + H2SO4 = CuSO4 + 2H2O
2) при неполном замещении атомов водорода образуются кислые соли; их образуют обычно многоосновные кислоты при избытке последних:
Сu(OH)2 + 2H2SO4 = Cu(НSO4)2 + 2H2O
3) при частичном замещении групп ОН- в молекуле основания кислотными остатками образуются основные соли:
2Сu(OH)2 + H2SO4 = (CuОН)2SO4 + 2H2O
Основные соли могут образованы только многокислотными основаниями.
Названия кислой соли складываются из названия соответствующей средней соли с приставкой «гидро», «дигидро» и т. д. (в зависимости от числа атомов во-дорода в кислотном остатке). Например: КНСО3 – гидрокарбонат калия; Са(Н2РО4)2- дигидрофосфат кальция.
Название основной соли складывается из названия соответствующей средней соли с прибавлением приставки «гидроксо», «дигидроксо» и т. д. (в зависимости от числа групп ОН- в основном остатке). Например: (BeOH)2CO3 – гидроксо-карбонат бериллия; Al(OH)2NO3 – дигидроксонитрат алюминия. При добавлении кислоты основные соли легко переходят в средние:
Al(OH)2NO3 + 2HNO3 = Al(NO3)3 + 2H2O
Для превращения кислой соли в нормальную соль следует добавить щелочи (основания):
Cu(НSO4)2 + Сu(OH)2 = 2CuSO4 = 2H2O
Принципы научной классификации, химические свойства, способы получения, взаимные превращения и названия всех рассмотренных важнейших классов неорганических соединений подробно описаны в учебно-методической литературе.
21.Приведите уравнения реакций получения указанных ниже солей из со-ответствующих кислот и оснований: фосфат хрома(П), гидрокарбонат бария, дигидроксосульфат алюминия.
22.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Железо→сульфат железа(III)→гидроксид железа(III)→оксид железа(III) →хлорид железа(III)→дигодроксохлорид железа(III).
23.С какими из перечисленных веществ - N2O5, Zn(OH)2, FeO реагирует гидроксид кальция? Составьте уравнения соответствующих реакций.
24. Напишите уравнения реакций, при помощи которых, исходя из четырех простых веществ – калия, серы, кислорода и водорода, можно получить три средние соли и три кислоты. Полученные соединения назовите.
25. Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно: оксид калия, оксид фосфора(V), гидроксида бария, серная кислота, иодид калия, нитрат свинца(II). Уравнения реакций, протекающих в растворах, изобразите в сокращенной ионной форме.
26. С какими из указанных ниже веществ может взаимодействовать раствор гидроксида калия: йодоводородная кислота, нитрат меди(II), хлорид стронция, оксид серы(IV), оксид свинца(II). Напишите уравнения реакций в молекулярной и сокращенной ионной форме.
27. Напишите уравнения реакций, при помощи которых можно получить гид-роксохлорид алюминия, гидросульфид калия, гидрокарбонат бария.
28. Какие кислоты могут быть получены при непосредственном взаи-модействии с водой следующих оксидов: Р2О5, СО2, СгО3, SO2, СO2?
29. Как осуществить следующие превращения:
Zn →ZnSO4 → Zn(OH)2 → Na2ZnO2 → Zn(NO3)2 →фосфат калия.
30. Как осуществить следующие превращения:
Аl → Al2O3 → Al(OH)3 → Ba(AlO2)2 → Al(NO3)3 → Na3AlO3.
31. Напишите уравнения реакций получения нормальных (средних), кислых и оcновных солей никеля(II), используя гидроксид никеля и фосфорную кислоту. Кислые и основные соли превратите в нормальную соль.
32.С какими из перечисленных веществ P2O5, Sn(OH)2, CoO, AgNO3, H2S, Al2O3 будет реагировать соляная кислота? Составьте ионные и ионно-молеку-лярные уравнения возможных реакций.
33. Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСl, Н2S, NO2, SО2, NН3, С12, N2? Напишите уравнения воз-можных реакций.
34. Приведите уравнения реакций получения ниже перечисленных солей, ис-ходя из соответствующих кислот и оснований: а) фосфат марганца(II); б) гид-роксокарбонат цинка; в) гидрофосфат калия; г) дигидроксосульфат алюминия.
35. Напишите молекулярные и ионные уравнения реакций образования средних солей из основных и кислых, подобрав для этого соответствующий реагент:
а) дигидоксонитрат алюминия→ нитрат алюминия + хлорид алюминия;
б) гидроксохлорид хрома(Ш) → хлорид хрома(Ш);
в) дигидрофосфат магния → фосфат магния;
г) гидрокарбонат кальция → карбонат кальция + карбонат натрия.
36. Составьте уравнения реакций, характеризующих химические свойства указанных ниже соединений: а) оксид железа(III); б) оксид фосфора(III); в) гид-роксид олова(II); в) оксид кремния(IV).
37. Составьте формулы нормальных (средних) и кислых солей калия и каль-ция, образованных: а) угольной кислотой; б) мышьяковистой кислотой. Напишите уравнения реакций их получения и приведите названия этих солей.
38. Составьте формулы нормальных и основных солей кальция и алюминия, образованных: а) соляной кислотой; б) серной кислотой. Напишите названия этих солей.
39.Составьте уравнения соответствующих реакций и определите, при каком соотношении основания и кислоты образуются гидроксосульфат, дигид-роксосульфат и гидросульфат хрома(Ш)? Все указанные соли переведите в сульфат хрома(III).
40.Напишите уравнения реакций, характеризующих химические свойства указанных соединений: оксид меди(П), оксид азота(V), гидроксид железа(III).
3. CТРОЕНИЕ АТОМА. МЕТОДИКА РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Пример 1. Составление электронных формул атомов элементов с учетом значений квантовых чисел электронов наружного слоя. Напишите электронную формулу атома элемента и назовите его, если значения квантовых чисел (n, l, ml ms) электронов наружного электронного слоя следующие: 4, 1, -1, + 1/2; 4, 1, 0, +1/2; 4, 1, +1, +1/2.
Решение. Состояние каждого электрона наружного энергетического уровня определяется следующим набором квантовых чисел:
1-й электрон: n = 4, l =1, ml = -1, ms = + 1/2;
2-й электрон: n = 4, l =1, ml = 0, ms = + 1/2;
3-й электрон: n = 4, l =1, ml = +1, ms = + 1/2;
Главное квантовое число равно четырем, следовательно, электроны находятся на 4-м энергетическом уровне. Орбитальное квантовое число определяет форму орбитали. Если l=1, то орбиталь называется р-орбиталью, следовательно, три электрона находятся на р-подуровне 4-го энергетического уровня. Магнитное квантовое число ml (-1, 0, +1) определяет ориентацию орбитали в пространстве. На всех трех р-орбиталях (рх, ру, рг) находится по одному электрону (ms = + l/2). Наружный энергетический уровень атома этого элемента содержит пять электронов: ...4s24p3. Такую электронную конфигурацию наружного энергетического уровня имеет атом мышьяка As, электронная формула которого следующая: Is22s22p63s23p63d104s24p3.
Пример 2.Изображение электронной структуры атомов элементов с помощью энергетических ячеек.Пользуясь правилом Гунда, распределите электроны по энергетическим ячейкам для атома элемента с порядковым номером 40.
Решение. Элемент с порядковым номером 40 - цирконий Zr, находится он в пятом периоде, IVВ подгруппе. Цирконий - это d-элемент. Электронная формула атома циркония - Zr 1s22s22p63s23p63d104s24p64d25s2.
Принимая во внимание правило Гунда, заполним энергетические ячейки следующим образом:
| 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 3d10 | 4s2 | 4p6 | 4d2 | 5s2 | ||||||||||||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑↓ | |||
Пример 3.Определение значений квантовых чисел для электронов атома элемента.Для атома с электронной структурой 1s22s2p1 найдите значения четырех квантовых чисел n, l, ml, ms, определяющие каждый из электронов в нормальном состоянии.
Решение. Электронную структуру 1s22s2p1 имеет атом бора. Значения квантовых чисел для электронов атома бора надо определять с учетом принципа Паули, согласно которому в атоме не может быть даже двух электронов, у которых все четыре квантовых числа были бы одинаковыми. 1-й энергетический уровень атома бора содержит два электрона в s-состоянии. Эти электроны характеризуются следующим набором квантовых чисел: 1,0, 0, ±1/2. Электроны в s-состоянии второго энергетического уровня имеют значения квантовых чисел: 2, 0, 0, ±1/2.
Квантовые числа 2, 1, -1, +1/2 описывают р-электрон второго энергетического уровня бора в р-состоянии. Значения квантовых чисел пяти электронов атома бора следующие:
| Квантовое число | Электрон | ||||
| n | |||||
| l | |||||
| ml | -1 | ||||
| s | +1/2 | -1/2 | +1/2 | -1/2 | +1/2 |
41.Приведите по два примера, относящихся к s-, p- и d-электронным семействам. Ответ мотивируйте строением внешних и предвнешних (для d-элементов) энергетических уровней атомов.
42.Внешние энергетические уровни атомов имеют вид 3s1; 5s25p2; 4s24p6; 2s22p5. В каких периодах и в каких подгруппах находятся эти элементы? К каким электронным семействам они принадлежат?
43.Сколько электронов находится на каждом энергетическом уровне и подуровне у атомов элементов с зарядом ядра +42; +28; +19? Составьте электронные формулы для атомов этих элементов.
44.Какие из электронных конфигураций соответствуют основному, возбужденному или запрещенному (невозможному) состоянию:
а) 1s22s22p53s3; б) 1s22s22p63s13p53d1; в) 1s22s22p63s23p64s24p64d45s1; г) 1s22s12p7.
45. Напишите электронные формулы атомов фосфора, цезия и ванадия. К какому электронному семейству относится каждый из этих элементов?
46. Какое максимальное число электронов могут занимать s-, р-, d- и f-орбитали данного энергетического уровня? Почему?
47. Какие значения имеют квантовые числа n, l, m и s для следующих атомных орбиталей: а)4s; б)2р; в)3d; г)4f?
48. Составьте электронную формулу атомов элементов с зарядом ядра +25 и +33. Покажите распределение валентных электронов в нормальном и возбужденном состояниях. Какие степени окисления возможны у этих элементов?
49. Сколько и какие значения может принимать магнитное квантовое число m при орбитальном квантовом числе l=0; 1; 2 и З? Какие элементы в Периодической системе носят названия s, p, d и f-элементов? Приведите примеры.
50. Какие значения могут принимать квантовые числа п, l, т1 и тs, характеризующие состояние электронов в атоме. Какие значения они принимают для внешних электронов атома фосфора?
51.Приведите по два примера, относящихся к p-, d- и f-электронным семействам. Ответ мотивируйте строением внешних и предвнешних (для d-элементов) энергетических уровней атомов.
52.Внешние энергетические уровни атомов имеют вид 4s1; 6s26p2; 5s25p6; 2s22p5. В каких периодах и в каких подгруппах находятся эти элементы? К каким электронным семействам они принадлежат?
53.Сколько электронов находится на каждом энергетическом уровне и подуровне у атомов элементов с зарядом ядра +24; +46; +55? Составьте электронные формулы для атомов этих элементов.
54.Какие из электронных конфигураций соответствуют основному, возбужденному или запрещенному (невозможному) состояниям:
a) 1s22s22p63s23p64s3; б) 1s22s22p63s13p33d1;
в) 1s22s22p63s23p64s24p6; г) 1s22s22p7.
55. Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов фосфора, алюминия, кремния и никеля. Сколько неспаренных электронов в атомах этих элементов в основном и возбужденном состояниях?
56. Определите значения всех квантовых чисел для электронов атомов:
а) лития; б) бора; в) азота; г) фтора.
57. Напишите электронные формулы атомов элементов с зарядом ядра:
а) +46; б) +105; в) +114 и в) еще не открытого элемента с зарядом ядра +120. К каким электронным семействам относятся эти элементы?
58.В электронных оболочках атомов трех элементов содержатся: а) 21 р-электрон; б)15 d-электронов; в) 20 f-электронов. Напишите полные электронные формулы этих элементов и назовите их. Какие степени окисления они могут проявлятъ в химических соединениях?
59.Какие орбитали атома заполняются электронами раньше: а) 4s или 3d;
б) 5s или 4р; в)5p или 4d? Почему? Составьте электронные формулы атомов эле-ментов с зарядом ядра +53 и +80.
60. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n = 3, l = 0, m = 0. Атомы каких эле-ментов имеют такой электрон? Составьте электронные формулы атомов этих элементов.
