Электрохимический ряд напряжений металлов. Вытеснение металлов из солей другими металлами
Металлы в химических реакциях всегда восстановители. Восстановительную активность металла отображает его положение в электрохимическом ряду напряжений.
На основании ряда можно сделать следующие выводы:
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из солей в растворе те металлы, которые стоят правее
2Fe + 3CuSO4 → 3Cu + Fe2 (SO4)3
3. Металлы, находящиеся в ряду напряжений левее водорода способны вытеснять его из кислот.
Zn + 2HCl → ZnCl2 + H2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные) в любых водных растворах прежде сего реагируют с водой.
Восстановительная способность металла, определённая по электрохимическому ряду не всегда соответствует его положению в периодической системе т.к в ряду напряжений учитывается не только радиус атома, но и энергия отрыва электронов.
Альдегиды, их строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.
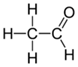 Этаналь
Этаналь
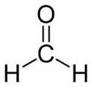 Метаналь (муравьиный альдегид)
Метаналь (муравьиный альдегид)
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства
 |
+ H2 = CH3OH
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Билет №12
Высшие оксиды химических элементов третьего периода. Закономерности в измерении их свойств в связи с положением химических элементов в периодической системе. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых является кислород со степенью окисления «-2»
К оксидам третьего периода относятся:
Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
С увеличением степени окисления элементов, увеличиваются кислотные свойства оксидов.
Na2O, MgO – основные оксиды
Al2O3 – амфотерный оксид
SiO2, P2O5, SO3, Cl2O7 – кислотные оксиды.
Основные оксиды реагируют с кислотами с образованием соли и воды.
MgO + 2CH3COOH → (CH3COO)2Hg + H2O
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щёлочи.
Na2O + HOH → 2NaOH
Основные оксиды реагируют с кислотными оксидами с образованием соли.
Na2O + SO2 → Na2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды
2NaOH + SO3 → Na2SO4 + H2O
Реагирует с водой, с образованием кислоты
SO3 + H2O → H2SO4
Амфотерные оксиды реагируют с кислотами и щелочами
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Со щёлочью
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Жиры, их свойства и состав. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения СМС.
Жиры – это сложные эфиры глицерина и карбоновых кислот.
Общая формула жиров:
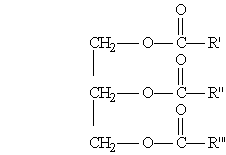
Твёрдые жиры образованы преимущественно высщими предельными карбоновыми кислотами – стеариновой C17H35COOH, пальмитиновой C15H31COOH и некоторыми другими. Жидкие жиры образованы главным образом высшими непредельными карбоновыми кислотами – олеиновойC17H33COOH, ленолевойC17H31COOH
Жиры наряду с углеводородами и белками входят в состав организмов животных и растений. Они являются важной составной частью пищи человека и животных. При окислении жиров в организме выделяется энергия. Когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются на глицерин и соответствующие кислоты.
Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный организм. Потоком крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до оксида углерода (IV) и воды.
Физические свойства.
Животные жиры в большинстве случаев твёрдые вещества, но встречаются и жидкие (рыбий жир). Растительные жиры чаше всего жидкие вещества – масла; известны и твёрдые растительные жиры – кокосовое масло.
Химические свойства.
Жиры в животных организмах в присутствии ферментов гидролизуются. Кроме реакций с водой, жиры взаимодействуют со щелочами.
В состав растительных масел входят сложные эфиры непредельных карбоновых кислот, то их можно подвергнуть гидрированию. Они превращаются в предельные соединения
Пример: Из растительного масла в промышленности получают маргарин.
Применение.
Жиры в основном применяют в качестве пищевого продукта. Раньше жиры использовали для получения мыла
Синтетические моющие средства.
Синтетические моющие средства оказывают вредное действие на окружающую среду, т.к. они устойчивы и с трудом подвергаются разрушению.
Билет №13
