Краткая теоретическая часть
Устойчивое равновесное состояние термодинамических систем характеризуется следующими общими условиями:
1) неизменностью равновесного состояния системы при сохранении внешних условий;
2) подвижностью равновесия (самопроизвольным восстановлением равновесия после прекращения внешнего воздействия, вызвавшего незначительное отклонение системы от положения равновесия);
3) динамическим характером равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов;
4) возможностью подхода к состоянию равновесия с двух противоположных сторон;
5) минимальным значением изменения изобарно-изотермического или изохорно-изотермического потенциалов ( 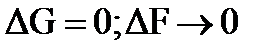 ). Выражением этих условий является закон действия масс (константы равновесия).
). Выражением этих условий является закон действия масс (константы равновесия).
Для химической реакции в общем виде 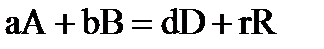 ,
,
протекающей в газовой фазе в изобарно-изотермических условиях, константа равновесия имеет вид: 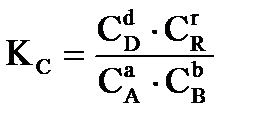 ;
; 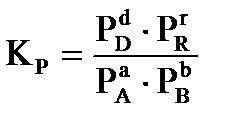 ;
;
где C и P- равновесные значения концентраций веществ (в моль/л), парциальных давлений в кПа, соответственно.
Константа равновесия, выраженная через парциальные давления компонентов газовой смеси, связана с константой Кс соотношением: 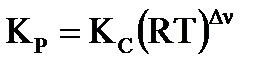 , где
, где 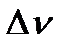 - изменение числа молей газа в реакции,
- изменение числа молей газа в реакции, 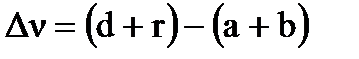 .
.
В основе термодинамического расчета констант равновесия и равновесных выходов продуктов лежит уравнение изотермы химической реакции Вант-Гоффа: 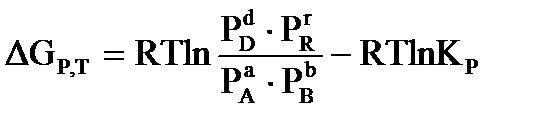 , где
, где 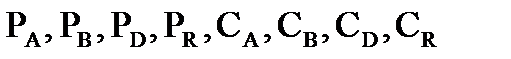 - произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
- произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
Для стандартного состояния системы, уравнения химического сродства имеют вид: 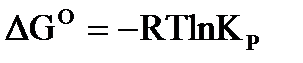 .
.
Для расчета константы равновесия можно применить уравнение изобары Вант-Гоффа 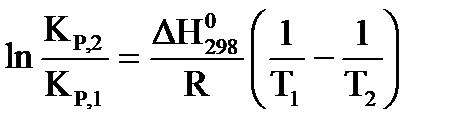 .
.
Важнейшие понятия: химическое равновесие, константа равновесия, уравнения изобары и изотермы реакции.
Следует уметь: приводить выражения кинетической и термодинамической констант равновесия; рассчитывать и связывать константу равновесия со свободной энергией Гиббса; определять направления смещения равновесия и оптимальные условия протекания процессов, используя принцип Ле- Шателье; рассчитывать температуру равновесного состояния системы.
Контрольные вопросы и задания:
1. Что называют химическим равновесием? Укажите термодинамическое и кинетическое условия равновесия.
2. Что называют константой равновесия, и от каких факторов она зависит? Приведите примеры для гомогенных и гетерогенных систем.
3. Сформулируйте принцип Ле-Шателье. Как влияет изменение внешних условий на состояние равновесия обратимой химической реакции?
СаСО3(т) = СаО(т) + СО2(г); ∆Н0 х.р. = 176,1 кДж/моль.
4. Рассчитайте температуру, при которой равновероятны оба направления реакции синтеза аммиака из азота и водорода.
5. Константа равновесия реакции N2O4 (г) = 2 NO2 (г) при 250 С равна 4,64∙10-3. В каком направлении будет идти реакция при следующих концентрациях веществ: С(N2O4) = 0,046 моль/л; С(NO2) = 0,0095 моль/л.
Экспериментальная часть
Опыт 1. Налейте в пробирку 4 – 5 мл разбавленного раствора роданида аммония (NH4CNS) и добавьте 4 – 5 мл разбавленного раствора хлорида железа (III) (FeCl3). Полученный раствор, характерная красная окраска которого обусловлена образующимся роданидом железа (III), разлейте поровну в четыре пробирки. Затем в первую пробирку добавьте концентрированного раствора роданида аммония, во вторую – концентрированного раствора хлорида железа (III), в третью пробирку –концентрированного раствора хлорида аммония, а раствор в четвертой пробирке оставьте для сравнения. Обратите внимание на изменение окраски растворов.
Приведите уравнение реакции в краткой ионной форме и выражение константы равновесия данной реакции. Объясните изменение окраски раствора с точки зрения закона действующих масс. Сделайте вывод о влиянии концентрации реагирующих веществ на химическое равновесие.
Опыт 2. Соли хромовой кислоты – хроматы окрашены в желтый цвет (цвет иона CrO4-2). Соли двухромовой кислоты – бихроматы окрашены в оранжевый цвет (цвет иона Cr2O7-2). В растворах хрома(VI) имеет место равновесие 2CrO4-2 + 2Н+ ↔ Cr2O7-2 + Н2О, которым можно управлять, изменяя концентрацию ионов водорода.
В пробирку поместите 3 – 4 капли 10% раствора бихромата калия и прибавляйте по каплям 2М раствор едкого кали до перехода оранжевой окраски в желтую. Затем к этому же раствору по каплям прибавляйте 2М раствор серной кислоты до появления вновь оранжевой окраски. Объясните изменение окраски раствора, анализируя уравнение изотермы Вант-Гоффа.
Лабораторная работа № 6. Гидролиз солей (2 часа)
Цель работы:изучение процесса гидролиза солей разного типа, установление количественных характеристик процесса гидролиза, изучение влияния различных факторов на степень гидролиза.
Рекомендации:по литературным источникам ознакомиться со следующими теоретическими основами - «Ионное произведение воды», «Сильные и слабые электролиты», «Гидролиз солей».
Важнейшие понятия:гидролиз солей, степень и константа гидролиза, водородный и гидроксильный показатели (PH и POH).
Следует уметь:сравнивать склонность к гидролизу иона в зависимости от его заряда и размера. Связывать склонность ионов к процессу гидролиза с силой соответствующих кислот и оснований, используя значения Кдис соответствующих ступеней ионизации кислот и оснований. Выражать процесс гидролиза с помощью ионных и молекулярных уравнений. Объяснять влияние температуры, концентрации ионов H+и ОН- и одноименных ионов на смещение ионного равновесия.
Контрольные вопросы и задания
1. Что называется ионным произведением воды? Каково его значение при 298К?
2. Что называется водородным показателем (рН)? Как его величина связана с гидроксильным показателем (рОН)?
3. Определите значение рН в растворах NaOH и H2SO3 при их концентрации 0,001 моль/л.
4. Дайте определение процессу гидролиза.
5. Какие (по природе ионов) соли подвергаются гидролизу по катиону, а какие – по аниону? Какие соли не подвергаются гидролизу? Приведите примеры, записав уравнение реакции гидролиза в ионном и молекулярном виде.
6. Что является следствием процесса гидролиза?
7. Охарактеризуйте понятия «степень гидролиза», «константа гидролиза».
8. От каких факторов зависит степень гидролиза?
9.Рассчитайте константу и степень гидролиза соли NH4CI, растворе с концентрацией 0,001 моль/л.
Экспериментальная часть
