Вопрос № 3. Оптические, кинетические и электрические свойства коллоидов (20 мин)
Молекулярно-кинетические свойства коллоидных растворов принципиально не отличаются от обычных молекулярных растворов. К ним относятся: броуновское движение, диффузия и осмос.
Под действием силы тяжести все коллоидные частицы оседают в растворе. Этот процесс называют седиментацией. Его скорость находится в прямой зависимости от размера частиц. Естественно, более крупные частицы оседают быстрее, чем мелкие.
Оптические свойства коллоидных растворов
При рассматривании коллоидного раствора в проходящем свете он кажется совершенно прозрачным. Если луч света направлен на коллоидный раствор сбоку, то его путь будет обнаруживаться на темном фоне в виде светящегося конуса, получившего название конуса Тиндаля.
В основе явления Тиндаля лежит рассеяние видимого света коллоидными частицами, которое связано с размерами коллоидных частиц и длиной волны падающего света. Частицы более крупные, чем световые волны (10-3 – 10-6 м), отражают их; очень мелкие частицы – молекулы и ионы низкомолекулярных веществ (10-10 м) пропускают свет; частицы, размеры которых соизмеримы с длиной полуволны r = l/2, а именно такими являются коллоидные частицы, рассеивают свет во все стороны: световые волны, наталкиваясь на подобные частицы, огибают их, и луч отклоняется от прямой линии (явление дифракции света).
По закону Рэлея, интенсивность рассеянного света (I) обратно пропорциональна четвертой степени волны падающего света:
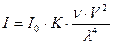 , где
, где
I – интенсивность рассеянного света;
I0 – интенсивность падающего света;
К – константа, зависящая от коэффициентов преломления дисперсной фазы и дисперсионной среды;
n – число частиц в 1 см3 золя (частичная концентрация);
V – объем отдельной частицы;
l – длина волны падающего света.
Из этого уравнения следует, что короткие волны (синяя и фиолетовая часть спектра) рассеиваются сильнее, чем длинные волны (желто-оранжевая часть спектра). Следовательно, если исходный свет белый, то рассеянный свет обогащается коротковолновыми компонентами и приобретает голубой оттенок, характерный для многих коллоидных систем при боковом освещении. Этим объясняется голубая окраска неба. В проходящем свете остается больше длинноволновых компонентов спектра, которые и придают ему красный оттенок.
На явлении рассеяния света коллоидными частицами основана работа ультрамикроскопа, с помощью которого возможно определить размер коллоидных частиц.
Строение коллоидных частиц
Всякий золь состоит из мицелл, которые составляют дисперсную фазу золя и дисперсионной среды, в состав которой входят растворитель и растворенные в нем электролиты и неэлектролиты.
Мицелла имеет сложное строение. Она состоит из яда, окруженного двойным электрическим слоем. Ядро составляет основную массу мицеллы и представляет собой агрегат из атомов или нейтральных молекул (обычно их число огромно – несколько сотен или тысяч). Ядро имеет кристаллическое строение.
Ядро окружено двойным электрическим слоем, который в свою очередь состоит из адсорбционного и диффузного слоев.
На ядре адсорбируются те ионы, которые входят в состав кристаллической решетки ядра. Они называются потенциалопределяющими ионами.
Они сообщают ядру заряд, вследствие чего вокруг ядра начинают группироваться противоионы, часть из которых располагается близко к ядру и вместе с потенциалопределяющими ионами образует адсорбционный слой.
Ядро + адсорбционный слой образуют гранулу, заряженную вследствие неполной компенсации заряда потенциалопределяющих ионов.
Остальные противоионы распределяются в дисперсионной среде диффузно, т.е. их концентрация по мере удаления от поверхности частицы убывает.
Гранула + диффузный слой противоионов составляют мицеллу. Мицелла электронейтральна.
Электролит, один из ионов которого адсорбирован на ядре, называется стабилизатором (обычно это электролит, который взят в избытке), он сообщает устойчивость коллоидным частицам.
Рассмотрим строение мицелл золя AgI. Его можно получить по реакции: KI + AgNO3 = AgI + KNO3. В зависимости от того, какой реагент взят в избытке, заряд золя будет разный.
При избытке AgNO3 формула мицеллы выглядит следующим образом:
{[ m(AgI)nAg+ (n-x)NO3-]x+ xNO3-}
ядро адсорбционный диффузный
слой слой
________________________
гранула
_______________________________
мицелла
m – количество молекул AgI;
n – число потенциалопределяющих ионов, адсорбированных на поверхности
ядра;
(n-x) – число противоионов в адсорбционном слое;
x – число противоионов в диффузном слое.
При избытке KI формула мицеллы выглядит следующим образом:
{[ m(AgI)nI -(n-x)K+]x- x K+}
ядро адсорбционный диффузный
слой слой
___________________
гранула
_________________________
мицелла
