Экзотермиялық тура бағытта реакция
2H2O2= H2O+ O2
2C + O2= 2CO
N2+ 3H2= 2NH3
Эндотермиялық процесс өнімнің шығымы:
Өзгермеген темпера өзгермейді
Температураны төмендеткенде кемиді
Температураны жоғарлатқанда артады
10%-дық 320 г  ерітіндісіне 80 г су қосылған. Ерітіндідегі қышқылдың массалық үлесі:
ерітіндісіне 80 г су қосылған. Ерітіндідегі қышқылдың массалық үлесі:



140 г 40%- дық  ерітіндісін дайындау үшін қажетті калий оксидінің массасы (г):
ерітіндісін дайындау үшін қажетті калий оксидінің массасы (г):



Г Al2S3-те алюминийдің массасы



200 г 4,5%- дық және 250г 18%-дық натрий сілтісі ерітіндісін құю арқылы алынған ерітіндідегі натрий гидроксидінің массалық үлесі:



Г аммиактың 4,48 л (қ.ж.) хлорсутекпен өзара әрекеттесуінен алынған өнімнің массасы



Г көмір қышқыл газындағы молекулалар саны
0,15*〖10〗^25
1,5*〖10〗^24
0,602*〖10〗^23
500 мл  ерітіндісінде 3,4 г. гидроксид –ион бар, еріген заттың молярлық концентрациясы (моль/л):
ерітіндісінде 3,4 г. гидроксид –ион бар, еріген заттың молярлық концентрациясы (моль/л):



C температурада және тепе-теңдік констансасы (К)3,34 тең ГИББс энергиясы (G)өзгереді
B)-10022Дж/моль
D)-100.22*10^2Дж/моль
Мл 0,2н ерітіндісімен қышқылдық ортада тотықтықтыратын массасы.



А + 2В «С жүйе үшін, тепе – теңдік концентрациялары [А] = 0,06 моль/л, [В] = 0,12 моль/л, [С] = 0,216 моль/л. Реакцияның тепе – теңдік константасын (К) мен А және В заттарының бастапқы концентрациясы:
[В0]=0,552 моль/л
К=2,5
[А0]=0,276 моль/л
 қатар бойынша:
қатар бойынша:
элемент және оттегінің арасындағы өзара әркеттесулер нашарлайды
негіздердің күші артады
термиялық беріктігі артады
Сu2+ иондарын сулы ерітіндісінде анықтау қиынға түсетін қосылыс:



 реакция жылдамдығы жүйенің қысымын екі, үші, төрт есе кеміткенде сәйкес төмендейді:
реакция жылдамдығы жүйенің қысымын екі, үші, төрт есе кеміткенде сәйкес төмендейді:
4 есе
16 есе
9 есе
 реакция жылдамдығы бір мезгілде қысымды 4 есе кеміткенде, температураны 600 (
реакция жылдамдығы бір мезгілде қысымды 4 есе кеміткенде, температураны 600 (  ) арттырғанда артады:
) арттырғанда артады:
 есе
есе
 есе
есе
 есе
есе
 молекулалығы (М) және реакция реті (n):
молекулалығы (М) және реакция реті (n):
n=2
М=n
М=2
 реакция түрі:
реакция түрі:
C) бейтараптану
D) су түзілу
F) алмасу
 қатар бойынша:
қатар бойынша:
оксоқышқылдардың күші төмендейді
термиялық беріктігі төмендейді
элементпен оттегінің арасындағы өзара әрекеттесулер төмендейді
 қатар бойынша:
қатар бойынша:
элементпен оттегінің арасындағы өзара әрекеттесулер күшейеді
оксоқышқылдардың күші артады
элементтің заряды артады
H^++ OH = H2O қысқартылған иондық молекулалық теңдеу үшін реагенттер:
Ва(ОН)2, НNO3
NaOH, H2SO4
 өз бетінше жүретін реакци үшін Гиббс энергиясының
өз бетінше жүретін реакци үшін Гиббс энергиясының  , энтальпияның
, энтальпияның  және энтропия
және энтропия  өзгеру белгісі:
өзгеру белгісі:
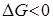


I А- топшасы элементтері үшін жоғарыдан төмен:
электрон тартқыштығы төмендейді
электртерістігі төмендейді
иондану энергиясы төмендейді
 электролиттік диссоциация константасы мәні бойынша ең әлсіз электролит:
электролиттік диссоциация константасы мәні бойынша ең әлсіз электролит:
 ;
; 




 Электролиттік диссоциация константасының мәні бойынша әлсіз электролит:
Электролиттік диссоциация константасының мәні бойынша әлсіз электролит:






КI ерітіндісінің электролизінде бөлінетін заттар:
H2
KOH
I2
NH3 молекуласының орталық атомының гибриттелу түрі, геометриялық пішіні және валенттік бұрышы:
тетраэдр


N2 молекуласындағы тотығу дәрежесі, валенттілігі және байланыс түрі:
үш байланыс
в=3
тотығу дәрежесі=0
NH4)Fe(SO4)2
Темір (3) амоний сулфаты
 , реакция үшін xимиялық тепе-теңдіктің кері реакция бағытына ығысатын жағдай:
, реакция үшін xимиялық тепе-теңдіктің кері реакция бағытына ығысатын жағдай:
аммиактың концентрациясы өскенде.
азоттың концентрациясы кемігенде.
сутектің концентрациясы кемігенде.
 реакция жылдамдығы сутегінің қысымын екі, үш және төрт есе арттырғанда сәйкесінше артады:
реакция жылдамдығы сутегінің қысымын екі, үш және төрт есе арттырғанда сәйкесінше артады:
8 есе
27 есе
64 есе
 еруі кезінде Гиббс энергиясының
еруі кезінде Гиббс энергиясының  , энтальпияның
, энтальпияның  және энтропия
және энтропия  белгісі өзгеруі:
белгісі өзгеруі:
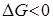


 ерітіндісінің еруі кезіндегі Гиббс энергиясының
ерітіндісінің еруі кезіндегі Гиббс энергиясының  , энтальпияның
, энтальпияның  және энтропияның
және энтропияның  таңбасының өзгеруі:
таңбасының өзгеруі:


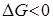
 және
және  гидроксидтері әрекеттеседі:
гидроксидтері әрекеттеседі:
күкірт қышқылымен
кальций гидроксидімен
азот қышқылымен
 әрекеттесе алады:
әрекеттесе алады:
күшті негізбен
күшті қышқылмен
cілтімен
 гальваникалық элементте жүретін тотығу-тотықсыздану реакциясы:
гальваникалық элементте жүретін тотығу-тотықсыздану реакциясы:



