Опыт 2. Зависимость скорости реакции от температуры
Лабораторная работа 3
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени.
Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. В общем случае для реакции
nA + mB = pАВ
зависимость скорости реакции выражается уравнением:
V = k CАn×CВm
где CА и CВ - концентрации реагирующих веществ; k - константа скорости реакции. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза:
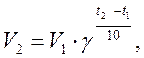 |
где V2 и V1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции.
 |
Выполнение работы
Зависимость скорости реакции от концентрации реагирующих веществ и температуры удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+ S↓ + H2O
Признаком реакции является помутнение раствора вследствие выделения серы. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить об относительной скорости реакции.
Опыт 1. Зависимость скорости реакции от концентрации
Реагирующих веществ
1.С помощью бюреток заготовьте три раствора тиосульфата различной концентрации. С этой целью отмерьте в первую пробирку 6 мл раствора тиосульфата натрия, во вторую - 4 мл того же раствора и 2 мл воды, в третью - 2 мл того же раствора и 4 мл воды.
2.В три другие пробирки отмерьте по 3 мл раствора серной кислоты.
3. Быстро прилейте кислоту в первую пробирку и встряхните ее несколько раз. Отмерьте время от начала реакции до помутнения раствора. Также поступите с другими заготовленными растворами тиосульфата.
4. Рассчитайте относительную скорость реакции по соотношению V = 100/τ. Результаты опыта внесите в табл. 1.
Таблица 1
| № п/п | Объем, мл | Относительная концентрация Na2S2O3, % | Время τ, с | Относительная скорость V=100/τ | ||
| Na2S2O3 | H2O | H2SO4 | ||||
| 66,7 | ||||||
| 33,3 |

Зависимость скорости реакции от концентрации реагирующих веществ выразите графически, откладывая на оси абсцисс относительную концентрацию, а на оси ординат - относительную скорость реакции. Какой  линией выражается найденная зависимость? Проходит ли она через начало координат и почему?
линией выражается найденная зависимость? Проходит ли она через начало координат и почему?
График 1.
Опыт 2. Зависимость скорости реакции от температуры
1.Налейте в три пробирки по 3 мл раствора тиосульфата натрия, в три другие пробирки - по 3 мл раствора серной кислоты.
2.Первую пару пробирок (кислота-тиосульфат) и термометр поместите в стакан с водой комнатной температуры. Через 3-5 мин, когда растворы в пробирках примут температуру воды, запишите показания термометра. Слейте растворы в одну пробирку и встряхните ее несколько раз. Определите время от начала реакции до появления заметной мути.
3.Для следующего определения в стакан подлейте горячей воды так, чтобы температура стала на 10°С выше. Поместите вторую пару пробирок и оставьте их на 3-5 мин, поддерживая температуру постоянной. Слейте содержимое пробирок и отметьте время. Повторите опыт с третьей парой пробирок, повысив температуру еще на 10°С. Данные опыта запишите в табл.2.
Таблица 2.
| № п/п | Температура t, °С | Время t, с | Относительная скорость V=100/τ |
Рассчитайте температурный коэффициент скорости реакции g, разделив V2 на V1 и V3 на V2. Найдите среднее значение g.
4.Зависимость скорости реакции от температуры выразите графически, откладывая на оси абсцисс температуру, а на оси ординат - относительную скорость. Проходит ли кривая через начало координат и почему?
 Сделайте вывод о влиянии температуры на скорость химической реакции.
Сделайте вывод о влиянии температуры на скорость химической реакции.
График 2.
Вывод.
