Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Примеры |
| sp sp2 sp3 dsp2 sp3d sp3d2 | Линейная Треугольная Тетраэдрическая Плоскоквадратная Гексаэдрическая Октаэдрическая | BeF2, CO2, NO2+ BF3, NO3-, CO32- CH4, ClO4-, SO42-, NH4+Ni(CO)4, XeF4PCl5, AsF5SF6, Fe(CN)63-, CoF63- |
68. Дисперсионные силы(дисперсионное притяжение, Лондоновские силы, Лондоновские дисперсионные силы, LDF) — силы электростатического притяжения мгновенного и индуцированного (наведённого) диполей электрически нейтральных атомов или молекул.
Происхождение дисперсионных сил было объяснено в 1930 году Фрицем Лондоном — немецким физиком-теоретиком[1]. Дисперсионные силы универсальны (то есть проявляются во всех случаях), так как они обусловлены взаимодействием атомов и молекул друг с другом за счёт их микродиполей[неизвестный термин]. Считается, что дисперсионная энергия не имеет классического аналога и определяется квантовомеханическими флуктуациями электронной плотности. Мгновенное распределение заряда одного атома или молекулы, характеризуемое мгновенным дипольным моментом, индуцирует мгновенный дипольный момент в другом атоме или молекуле[2]. При сближении атомов или молекул ориентация микродиполей перестаёт быть независимой, и их появление и исчезновение в разных атомах и молекулах происходит в такт друг к другу. Синхронное появление и исчезновение микродиполей разных атомов и молекул сопровождается их притяжением.[3]
В результате возникает взаимодействие этих моментов. Потенциальная энергия дисперсионного взаимодействия Eдисп. = -C/R6. Коэффициент C приближённо вычисляют по формуле:
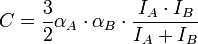
, где α Aи α B— электронные поляризуемости атомов или молекул, I A IB — потенциалы ионизации атомов или молекул, R — расстояние между атомами и молекулами.[2]
Дисперсионное взаимодействие (притяжение) возникает между всеми атомами и молекулами.
Межатомное взаимодействие сопровождается рекомбинацией атомов с образованием молекулы за исключением атомов инертных газов, которые сохраняют свою индивидуальность. Так, все инертные газы при нормальных условиях моноатомны. Однако, дисперсионные силы обуславливают возможность существования различных агрегатных состояний инертных газов (газ, жидкость и твёрдые тела).
