Нитровании толуола, близкое к структуре переходного состояния
Аналогичный эффект наблюдается и при изменении объема атакующего электрофильного реагента. Например, усиление сольватации нитроний-иона или образование его комплексов с донорами электронов (пиридин, ацетонитрил, простые и сложные эфиры), приводящее к увеличению эффективного объема реагента, также уменьшает соотношение орто/пара (см. ниже, стр. 40-42).
Еще одним примером влияния объема электрофильного реагента на соотношение орто/пара могут служить, например, изменения в позициионной селективности при электрофильном хлорировании, нитровании, бромировании и сульфировании хлорбензола. Эффективный объем электрофильного реагента (Cl+, NO2+, Br+, +SO3H) увеличивается в указанной последовательности, что приводит к уменьшению орто/пара–соотношения (табл.2).
Таблица 2 - Орто/пара-соотношение при электрофильном
замещении в молекуле хлорбензола
| Электрофильный реагент | орто-, % | пара-, % |
| Cl+ | ||
| NO2+ | ||
| Br+ | ||
| HSO3+ |
Пространственные препятствия сопряжению могут возникать тогда, когда заместители в ядре нарушают копланарность фрагментов, участвующих в сопряжении.
Например, в молекуле N,N-диметиланилина (+М-заместитель) ось р –орбитали неподеленной пары электронов азота параллельна осям π-орбиталей цикла (т.е.эти фрагменты копланарны), что обеспечивает максимальное боковое перекрывание этих орбиталей, делокализацию π-электронов и, соответственно, максимальную стабильность такого соединения (см. рис 7).
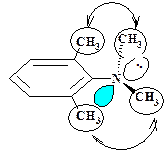
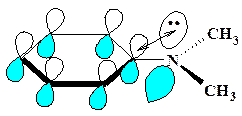
Рисунок 7. р, π –Сопряжение в Рисунок 8. Нарушение р, π –сопряже-
Молекуле N,N-диметиланилина жения в молекуле 2,6- диметил- N,N-
Диметиланилина
Однако при введении в орто-положения цикла двух метильных групп диметиламиногруппа уже не может сохранить копланарность с ядром из-за пространственных затруднений и поворачивается вокруг связи Сsp2 –N, что нарушает p,π –сопряжение и дестабилизирует молекулу (рис.8).
Это выражается, во-первых, в повышении основности 2,6-диметилпроизводного, т.к. неподеленная пара электронов (НПЭ) атома азота становится более доступной для протонирования и, во-вторых, в уменьшении дробных отрицательных зарядов орто- и пара-углеродных атомов кольца. Поэтому, например, N,N-диметиланилин легко атакуется в пара-положение катионом фенилдиазония PhN  ≡N в реакции азосочетания, тогда как 2,6-диметилпроизводное не подвергается азосочетанию в этих условиях, несмотря на то, что введенные в ядро метильные группы невелики по объему и не могут мешать атаке в пара-положение цикла.
≡N в реакции азосочетания, тогда как 2,6-диметилпроизводное не подвергается азосочетанию в этих условиях, несмотря на то, что введенные в ядро метильные группы невелики по объему и не могут мешать атаке в пара-положение цикла.
