Некоторые важнейшие α-аминокислоты
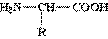
| Название | —R |
| Глицин | —Н |
| Аланин | —СН3 |
| Цистеин | —CH2—SH |
| Серин | —CH2—ОН |
| Фенилаланин | —CH2—C6H5 |
| Тирозин | 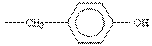 |
| Глутаминовая кислота | —CH2 —CH2 —СООН |
| Лизин | —(CH2)4—NH2 |
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т.д.
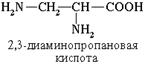
Наличие двух или трех карбоксильных групп отражается в названии суффиксом -диовая или -триовая кислота:
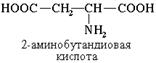
ПОЛУЧЕНИЕ АМИНОКИСЛОТ.
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
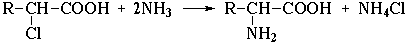
2. Присоединение аммиака к α,β-непредельным кислотам с образованием β-аминокислот (против правила Марковникова):
CH2=CH–COOH + NH3 à H2N–CH2–CH2–COOH
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O2N–C6H4–COOH + 3H2 à H2N–C6H4–COOH + 2H2O
СВОЙСТВА АМИНОКИСЛОТ.
Физические свойства.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2-COOH ⇄ +H3N-CH2-COO-
ХИМИЧЕСКИЕ СВОЙСТВА.
1. Кислотно-основные свойства: Аминокислоты — это амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями: H2N-CH2-COOH + HCl à Cl[H3N-CH2-COOH] H2N-CH2-COOH + NaOH à H2N-CH2-COONa + H2O Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой: 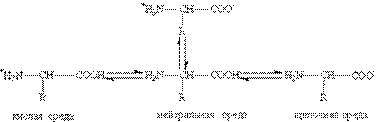 Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин— щелочной (одна группа -СООН, две -NH2). Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин— щелочной (одна группа -СООН, две -NH2). |
| 2. Как кислоты, аминокислоты могут реагировать с металлами, оксидами металлов, солями летучих кислот: 2H2N-CH2-COOH +2 Na à 2H2N-CH2-COONa + H2 2H2N-CH2-COOH + Na2O à 2H2N-CH2-COONa + H2O H2N-CH2-COOH + NaHCO3 à H2N-CH2-COONa + CO2 ↑+ H2O |
| 3. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир: H2N-CH2-COOH + C2H5OH –(HCl)à H2N-CH2-COOC2H5 + H2O |
4. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид. 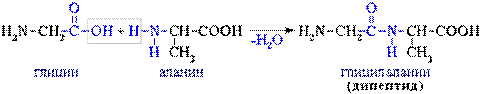 Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью. Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH глицилаланилглицин Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью. Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH глицилаланилглицин |
| 6. При нагревании разлагаются (декарбоксилирование): NH2-CH2-COOH –(t)à NH2-CH3 + CO2 амин |
| 7. Декарбоксилирование NH2-CH2-COOH +Ва(ОН)2 –(t)à NH2-CH3 + ВаCO3 + Н2О амин |
| 8. С азотистой кислотой: NH2-CH2-COOH + HNО2 à HO-CH2-COOH + N2 + Н2О |
