Функции кислотности и развитие теории нитрования
Для константы равновесия ионизации катионной кислоты ВН+ (связанной с константой основности сопряженного основания КВ уравнением
рКВ=14-рКВН+) в термодинамической шкале (т) справедливо ур-ние (6.2.1)
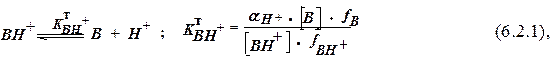
где αН+ - активность протонов, fB иfBH+-соответственно, коэффициенты активности основания Ви его протонированной формы ВН+, в квадратных скобках - концентрации компонентов.
Рассчитать коэффициенты активности ионов по уравнению Дебая-Хюккеля* можно до концентрации около 0.1 моль/л, что соответствует рН среды примерно 1.
Кислотность соединений ВН+, сопряженные основания которых в заметной степени не протонированы при таком значении рН, измерить обычными способами (потенциометрически или спектрофотометрически в буферных растворах) невозможно. Чтобы избежать трудностей, связанных с определением или расчетом переменных коэффициентов активности fB и fBH+, Гамметом в 1932 г было постулировано, что в серии сходных по структуре оснований отношение fB /fBH+ не зависит от их природы, а определяется только свойствами среды. Для характеристики протонирующей способности среды по отношению к определенному классу оснований Гамметом была предложена функция кислотности Но (ур-ние 6.2.2):

Эта функция является продолжением шкалы рН в сильно кислых средах.
______________________________________________________________
*И.В.Целинский, И.В.Шугалей. Кислотно-основные свойства органических соединений азота / Текст лекций. Санкт-Петербург, СПбГТИ (ТУ), ИК “Синтез”, 2006
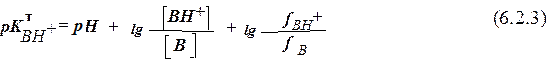 Из ур-ния (6.2.1), в логарифмической форме имеющем вид (6.2.3)
Из ур-ния (6.2.1), в логарифмической форме имеющем вид (6.2.3)
и ур-ния (6.2.2) следует, что

Это уравнение используется для определения констант основности слабых органических оснований.
Для вывода функции Но Гамметом была выбрана опорная серия замещенных нитроанилинов в качестве кислотно-основных индикаторов.
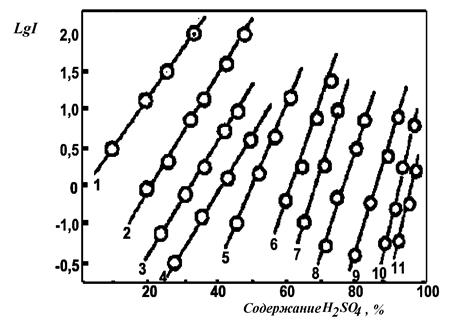
В зависимости от природы и количества заместителей в бензольном ядре (в основном это атомы галогенов и нитрогруппы) эти основания с постоянным реакционным центром – первичной аминогруппой – позволили оценить кислотность минеральных кислот в очень широкой области Но (10-11 лог.ед). Так, значение рКВН+ 4-нитроанилина (рис.10, прямая 1) измерили спектрофотометрическим способом в разбавленных растворах кислот, где действует шкала рН, это значение составляет 0.99. Затем было измерено ионизационное отношение [BH+]/[B]=I этого индикатора в более концентрированной серной кислоте.
Поскольку величина I может быть достаточно точно измерена спектрофотометрически лишь в области от 10-2 до 102, при помощи 4-нитроанилина как индикатора функция кислотности Но была выведена для концентраций H2SO4 вплоть до 24%. В этой же области концентраций (9-24% H2SO4) удалось измерить ионизационное отношение для следующего по основности индикатора – 2-нитроанилина (см. табл.5).
Таблица 5 - Значения рКВН+ нитроанилинов RNH2 в водных растворах
серной кислоты
| № п/п | R | рКВН+ | № п/п | R | рКВН+ |
| 4-NO2С6Н4 | 0.99 | 2,4-(NO2)2 С6Н3 | -4.53 | ||
| 2- NO2 С6Н4 | -0.29 | 2,6-(NO2)2 С6Н3 | -5.54 | ||
| 4-Cl-2-NO2 С6Н3 | -1.03 | 2-Br-4,6-(NO2)2 С6Н2 | -6.68 | ||
| 2,5-Cl2-4-NO2 С6Н2 | -1.78 | 3-CH3-2,4,6-(NO2)3 С6Н | -8.22 | ||
| 2-Cl-6-NO2 С6Н3 | -2.43 | 3-Br-2,4,6-(NO2)3 С6Н | -9.46 | ||
| 2,6-Cl2-4-NO2 С6Н2 | -3.27 | 2,4,6-(NO2)3 С6Н2 | -10.10 |