Определение молярной массы растворенного вещества
Криоскопическим методом
Приборы и материалы
1. Криоскоп – прибор для криоскопических измерений
2. Термометр Бекмана
3. Термометр со шкалой от - 10°С до 10 – 50°С
4. Дистиллированная вода
5. Лед, соль для охлаждения
6. Задача (выдается инженером)
Краткая теория к работе
Криоскопия – это метод физико-химического исследования, основанный на измерении понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
Для разбавленного идеального бинарного раствора понижение температуры замерзания пропорционально моляльности раствора и зависит от природы растворителя
DТ = Т0 – Т = K . m (IV)
где Т0 – температура замерзания растворителя,
Т- температура замерзания раствора,
m– моляльная концентрация раствора,
К– коэффициент пропорциональности.
Если m= 1, т.е. 1 моль вещества растворен в 1000 г растворителя, тоDТ = К, поэтому постояннуюКв уравнении (IV) называютмоляльным понижением температуры замерзания раствора, иликриоскопической постоянной. Она зависит только от природы растворителя и не зависит от концентрации раствора и химического состава растворенного вещества.
Для экспериментального определения К следует измерить понижение температуры замерзания в разбавленных растворах, а затем пересчитать эти данные на 1 моль:
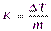 , m= 1 моль/1000 г р-ля,
, m= 1 моль/1000 г р-ля, 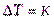 (V)
(V)
Криоскопическую постоянную можно вычислить теоретически, зная температуру замерзания растворителя Т0, его молярные массу М0и теплоту плавленияDНпл., по уравнению:
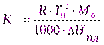 (Va)
(Va)
Криоскопические постоянные некоторых растворителей приведены в таблице:
| Растворитель | К, К/моль | Тзам., К |
| Вода | 1,86 | 273,2 |
| Бензол | 5,10 | 278,7 |
| Нитробензол | 6,90 | 278,9 |
| Фенол | 7,80 | 313,2 |
| Камфора | 40,00 | 451,2 |
Если из раствора при замерзании выпадают кристаллы чистого растворителя, то понижение температуры замерзания раствора используют для определения молярной массы растворенного вещества (М).
Если в q0г растворителя растворено q г вещества, то моляльность полученного раствора (m) равна:
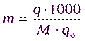 (VI)
(VI)
Подставляя это выражение в формулу (1), получим:
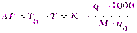 ,
,
откуда молярная масса растворенного вещества (М) равна:
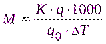 (VII)
(VII)
Массы q0иqнаходят взвешиванием;К(для данного растворителя) – постоянная величина. Следовательно, опыт сводится к определениюDТ, т.е. к определению понижения температуры замерзания раствора, приготовленного изq0 г растворителя иqг растворенного вещества.
Криоскопический метод применим только к разбавленным растворам, вследствие чего для DТ получаются очень небольшие значения. При выполнении этой работы пользуются термометрами, позволяющими делать отсчет с точностью.
Описание прибора
Для криоскопических измерений применяется прибор, предложенный Бекманом, схема которого приведена на рис.2.
Основная часть прибора – стеклянная пробирка-криоскоп (1), в которую во время опыта заливают исследуемый раствор или растворитель. Пробирка (1) плотно закрывается пробкой, через отверстие которой вставляются термометр (2) и мешалка (3) из тонкой проволоки, конец которой загнут в виде кольца, свободно охватывающего термометр. Пробирка бόльшего размера (4) служит воздушной “рубашкой”, в которую может помещаться пробирка (1) во время опыта и используется для более равномерного охлаждения. Собранный прибор через отверстие в крышке погружают в толстостенный стакан (5), который предварительно должен быть заполнен охладительной смесью (вода с толченым льдом и солью). Мешалку (6) из толстой проволоки используют для перемешивания охладительной смеси.
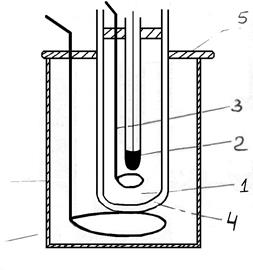
Рис. 2. Прибор для криоскопических измерений
В криоскопических опытах для измерения температуры используются приборы особого вида - термометры Бекмана (дифференциальные, или разностные термометры). Они отличаются от обычного, во-первых, большой шкалой (точной), позволяющей наблюдать изменение температуры до 0,0050и, во-вторых, вторым запасным ртутным резервуаром, при помощи которого можно изменять количество ртути в основном (нижнем) резервуаре и тем значительно расширить диапазон измеряемых температур. Шкала такого термометра, имеющего длину 25-30 см, поделена всего на 50с отметками между ними десятых и сотых долей. Переводя некоторое количество ртути из нижнего резервуара в верхний, или добавляя ртуть из верхнего в нижний, всегда можно настроить термометр так, чтобы температура замерзания данного растворителя попала бы на середину этой условной шкалы (между 40и 20). Особая конструкция этого термометра требует специальной настройки, которую осуществляетлаборант или инженер.
Подготовленный к работе термометр Бекмана следует держать в стакане со льдом.При вынимании изо льда термометр нагревается, ртутный столбик поднимается в капилляре до места соединенияегос запасным резервуаром, поэтому нужно следить за тем, чтобы капля ртути не сорвалась и не упала в запасной резервуар, т.к. это собьёт настройку термометра и повлечет за собой повторение всех операций в работе.
Порядок выполненияработы
1. Стакан (5) заполняют на 2/3охладительной смесью (вода, толченый лед, соль). Обычным термометром измеряют температуру охладительной смеси, которая должна в течение всего опыта поддерживаться от – 40 до – 50С. При более низкой температуре охладительной смеси получается излишне быстрое охлаждение жидкости и резкое ее переохлаждение, что приводит к неправильному определению температуры замерзания.
2. В чистую пробирку (1) цилиндром отмеряют точный объем дистиллированной воды до такого уровня, чтобы нижний резервуар термометра Бекмана был полностью погружен в нее, но не касался дна пробирки (не более 20 мл). Затем пробирку с водой охлаждают, поместив ее в стакан с охладительной смесью.
3. Определение приближенного значения температуры кристаллизации растворителя (Т0¢).
Термометр Бекмана из стакана со льдом переносят в пробирку с охлажденной водой, укрепляют с помощью пробки, в которую вставлена мешалка (3) и помещают криоскоп в стакан с охладительной смесью. Воду в пробирке и охладительную смесь все время перемешивают с помощью мешалок (3) и (6), наблюдая за ртутным столбиком и появления кристаллов льда в пробирке. Температура начала выпадения кристаллов льда чистой воды и будет приближенным значением температуры кристаллизации растворителя Т0¢. Затем пробирку с водой вынимают из охладительной смеси, нагревают рукой при перемешивании мешалкой (3) до полного растворения кристаллов.Следить за тем, чтобы ртутная капля не оторвалась в запасной резервуар!Определив приблизительную температуру кристаллизации воды, измерения повторяют 2 – 3 раза до получения воспроизводимых результатов. Не следует допускать длительного замораживания воды, чтобы термометр не “вмерз” в лед. В этом случае вынимать термометр из пробирки можно только после расплавления льда, т.к. в противном случае из-за примерзания нижнего резервуара со ртутью к стенке криоскопа термометр может быть поврежден.
4. Определение точного значения температуры кристаллизации растворителя (Т0)проводят из переохлажденной жидкости. Если бы переохлаждения не было, в особенности при определении температуры замерзания растворов, которая понижается по мере увеличения концентрации раствора вследствие кристаллизации растворителя. Поэтому при отсутствии переохлаждения ртуть в капилляре непрерывно и равномерно опускалась бы ниже точки замерзания раствора, и температуру замерзания раствора нельзя было бы точно отсчитать. Для растворов температурой замерзания считается температураначала кристаллизации чистого растворителя.
Погружают пробирку с водой в охладительную смесь и, помешивая, охлаждают до температуры Т0¢+20. После достижения этой температуры мешалку (3) поднимают вверх и закрепляют в таком положении, чтобы она не находилась в растворе. Помешивая мешалкой (6), охлаждают пробирку до температуры Т0¢+ 0,50и быстро надевают «рубашку», снова погружают собранный прибор в охладительную смесь и продолжают охлаждение, помешивая только охладительную смесь мешалкой (6) до температуры Т0¢– 1,50(т.е. ниже истинной температуры замерзания). После этого вызывают кристаллизацию переохлажденной воды с помощью мешалки (3). Из-за выделяющейся при этом теплоты кристаллизации температура резко повышается до значения истинной температуры кристаллизации некоторое время остается постоянной. Отмечают максимальное показание термометра Т0, которое соответствует истинной температуре замерзания воды.
Снова расплавляют выпавшие кристаллы и повторяют опыт не менее трех раз, добиваясь расхождения в значениях Т0не более 0,0050. После этого находят среднее значение истинной температуры замерзания Т0.
5. Определение температуры замерзания раствора.
От инженера или преподавателя получают исследуемое вещество для определения его молекулярной массы.
Берут точную навеску исследуемого вещества q1= 1 г сначала на технических, затем, на аналитических весах, растворяют его в воде, находящейся в пробирке и охлаждают раствор в стакане с охладительной смесью. Затем в охлажденный раствор вносят термометр Бекмана и определяют сначала приблизительную (Т¢) (см. п.3), а затем истинную (Т) температуру замерзания раствора.
Так как кристаллизация, как правило, начинается после некоторого переохлаждения раствора, температура при этом быстро повышается, достигая истинной температуры замерзания, соответствующей раствору данной концентрации, а затем, в связи с выделением кристаллов растворителя (воды) концентрация раствора увеличивается, что ведет к понижению температуры замерзания – поэтому не следует допускать длительного замораживания раствора.
Истинную температуру замерзания раствора определяют не менее трех раз (до получения воспроизводимых результатов). Таким образом, получают понижение температуры замерзания раствора: Т0– Т =DТ
Результаты отдельных измерений и окончательный результат определения молярной массы записать в таблицу по образцу.
