Возрастание степени гидратации
Такие ряды, в которых ионы расположены в порядке убывания или возрастания коагулирующей способности, называют лиотропными рядами.
6. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию. Например, при коагуляции хлоридом бария золя сульфида мышьяка, частицы которого имеют отрицательный заряд, в осадке содержится некоторое количество Ва2+.
7. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое (аддитивное) действие; обычно имеет место взаимное усиление (синергизм ионов) либо ослабление коагулирующего действия (антагонизм ионов).
Проанализируйте кинетические закономерности коагуляции золей в зависимости от концентрации электролита-коагулянта.
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени. Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от концентрации электролитов. Типичный вид коагуляционной кривой (зависимости отношения концентрации коллоидных частиц n к их начальной концентрации no от времени t) и кривой зависимости скорости коагуляции V (количество «слипшихся» частиц за единицу времени) от концентрации электролита С показан на рисунках.
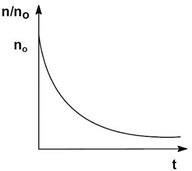
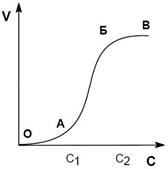
На кривой ОАБВ отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А при концентрации электролита C1 начинается явная коагуляция: на участке АБ скорость коагуляции резко возрастает с ростом концентрации электролита (медленная коагуляция). Очевидно, что скорость коагуляции возрастает благодаря снижению энергетического барьера (Eакт), препятствующего сближению частиц. Константа скорости коагуляции может быть выражена уравнением Аррениуса:
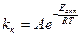
На участке БВ (быстрая коагуляция) скорость коагуляции остается постоянной; это связано с тем, что при концентрации электролита С2 величина z-потенциала становится равной нулю (т. е. уже отсутствует энергетический барьер и практически каждое столкновение частиц приводит к их агрегации), скорость коагуляции при этом достигает максимального значения.
Вопросы и задания для самоконтроля знаний по материалу 14-й лекции
1 Объясните причины, которые вызывают неустойчивость дисперсных систем и их постепенную эволюцию.
2 Какие два процесса вызывают уменьшение свободной энергии дисперсных систем?
3 Какой фактор обусловливает седиментационную неустойчивость дисперсных систем?
4 В чем заключается основное отличие коагуляции от коалесценции?
5 Приведите основные положения теории устойчивости гидрофобных золей Дерягина-Ландау-Фервея-Овербека (ДЛФО).
6 Что такое расклинивающее давление? Каков его физический смысл?
7 Какие варианты поведения коллоидной системы возможны в зависимости от соотношения величины потенциального барьера, глубины потенциальных ям и кинетической энергии частиц дисперсной фазы.
8 Дайте определение коагуляции. Приведите ее количественные характеристики.
9 Проанализируйте два возможных механизма влияния электролитов на устойчивость гидрозолей.
10 Обоснуйте правило Шульце-Гарди используя положения теории ДЛФО. Чем можно объяснить неполное соответствие теоретически полученных порогов коагуляции с экспериментальными результатами?
11 Сформулируйте основные закономерности электролитной коагуляции (правила коагуляции).
12 В чем суть явления коллоидной защиты? Для чего оно применяется?
13 Укажите принцип, который определяет порядок расположения ионов в лиотропных рядов Гофмейстера. Дайте обоснование этому принципу.
14 Приведите пример взаимной коагуляции двух золей. Каков ее механизм?
15 Рассмотрите влияние концентрации электролита на скорость коагуляции.
16 Получите уравнение Гельмгольца-Смолуховского, описывающее зависимость скорости коагуляции от концентрации частиц дисперсной фазы.
Знакомимся с основными понятиями физической химии (для курсантов военного факультета)
Повторяем курс физической химии (для студентов химического факультета)
1. ...............
Словарь основных определений физической химии, необходимых для изучения курса коллоидной химии
1. Физическая химия изучает взаимосвязь между химическими и физическими явлениями.
2. Термодинамика изучает взаимные переходы энергии из одной формы в другую, энергетические эффекты, сопровождающие различные физические и химические процессы, возможность, направление и предел протекания самопроизвольных процессов.
3. Система – тело или совокупность тел, находящихся во взаимодействии и отделенных от окружающей среды реальной или воображаемой границей.
Если система не обменивается с окружающей средой ни энергией, ни веществом, то она называется изолированной.
Системы, не обменивающиеся с окружающей средой частицами, но взаимодействующие путем обмена энергией (теплообмен, работа, излучение), называются закрытыми.
Системы, обменивающиеся со средой и веществом и энергией, называются открытыми.
4. Параметры системы – величины, определяющие состояние системы. Параметры системы могут быть экстенсивными и интенсивными.
Экстенсивные параметры – зависят от массы или количества вещества, входящего в систему (общий объем, теплоемкость).
Интенсивные параметры не зависят от массы и имеют одинаковые значения во всех точках системы (плотность, температура, мольный объем).
Экстенсивные параметры, отнесенные к единице количества вещества (мольные) или единице массы (удельные) приобретают свойства интенсивных параметров.
5. Состоянием называется данная совокупность величин параметров системы. Если хотя бы одна из величин меняется, то изменяется и состояние системы.
Состояние называется стационарным, если оно не меняется во времени.
Состояние называется равновесным, если в системе не только все параметры постоянны, но и нет никаких стационарных потоков за счет действия каких-либо внешних источников, т. е. стационарность не обусловлена никакими внешними процессами.
6. Если параметры системы (все или некоторые) изменяются с течением времени, то говорят, что в системе происходит процесс. Если параметры системы меняются бесконечно медленно, а система последовательно проходит ряд состояний, бесконечно мало отличающихся от равновесного, то процесс называют квазистатическим или равновесным.
Процессом называется ряд последовательных изменений состояния системы.
Необратимым называют неравновесный процесс, который протекает в результате конечных воздействий на систему и не изменяет направление под влиянием бесконечно малой силы.
В термодинамике важными являются понятия равновесного и обратимого процессов.
Равновесным называется процесс, проходящий через непрерывную последовательность состояний равновесия, т. е. состояний, при которых длительное время сохраняются постоянными термодинамические параметры (T, p, V, ρ и др.). Любое другое изменение состояния будет неравновесным.
Равновесный процесс должен протекать бесконечно медленно, поэтому он практически не реализуем (является абстракцией), хотя можно приблизиться к этому идеальному случаю сколь угодно близко.
Термодинамические процессы могут быть обратимыми и необратимыми. Обратимым называется процесс, который совершается таким образом, что после его окончания систему можно возвратить в исходное состояние, причем никаких изменений в окружающей среде не остается. Процессы, которые не удовлетворяют этому условию, называются необратимыми.
Равновесному процессу свойственны максимальная работа и двусторонность, т. е. обратимость. Обратимым называют равновесный процесс, который может возвратиться в первоначальное состояние без каких-либо энергетических изменений в окружающей среде или в самой системе под влиянием бесконечно малой силы.
Следует понимать, что термодинамическое понятие необратимости не совпадает со значением этого термина в химической кинетике, где обратимой реакцией называют такую реакцию, которая может протекать в прямом и обратном направлениях без каких-либо дополнительных ограничений. Химическая обратимость характеризует направление процесса, а термодинамическая – способ его проведения.
7. Самопроизвольные процессы – это такие процессы, в ходе которых система приближается к состоянию равновесия, из которого она самопроизвольно выйти не может.
Внутренняя энергия U характеризует общий запас энергии системы.
Энтальпия H – внутренняя энергия, которой обладает система, находящаяся при постоянном давлении; энтальпия численно равна сумме внутренней энергии U и потенциальной энергии pV: H = U + pV
Передача энергии от системы к окружающей среде и наоборот осуществляется в виде теплоты и работы.
Работа – количественная характеристика переданной энергии. Работа, проделанная системой, положительна, а работа, проделанная над системой – отрицательна.
Энергия Гиббса, как и энергия Гельмгольца характеризует способность системы совершать работу, т. е. определяет ту часть энергии, которая в изобарно-изотермическом процессе (p = const, T = const) превращается в работу. Убыль энергии Гиббса больше или равна максимальной полезной работе: -ΔG = W*.
Физические и химические явления исследуются в термодинамике главным образом с помощью двух основных законов, называемых первым и вторым началами термодинамики.
Первое начало термодинамики устанавливает постоянство (неуничтожимость) энергии при взаимных превращениях ее различных форм: «Энергия изолированной системы постоянна», «Энергия не возникает из ничего и бесследно не исчезает, переход ее из одного вида в другой осуществляется в эквивалентных количествах: Q = DU+W». Первое начало термодинамики не дает никаких указаний о направлении процессов, их возможности или невозможности.
Второе начало термодинамики характеризует направление процессов. В изолированных системах энтропия остается постоянной или увеличивается dS ≥ 0. Знак «больше» относится к необратимым процессам.
Энтропия – это термодинамическая функция, которая показывает, как изменяется рассеивание энергии при переходе системы из одного состояния в другое.
В общем виде 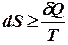 (элементарная приведенная теплота равна полному дифференциалу энтропии). Знак «больше» относится к необратимым процессам.
(элементарная приведенная теплота равна полному дифференциалу энтропии). Знак «больше» относится к необратимым процессам.
Энтропию можно рассматривать как вероятность нахождения системы в данном состоянии. В самопроизвольных процессах энтропия увеличивается. Энтропия – мера упорядоченности системы, чем меньше порядка, тем больше энтропия.
Итак, энтропия является функцией, определяющей возможность протекания самопроизвольного процесса в изолированной системе.
Для закрытых систем аналогичными функциями являются термодинамические потенциалы: энергия Гельмгольца A (изхорно-изотермический потенциал) и энергия Гиббса G (изобарно-изотермический потенциал).
A = U – TS
G = H – TS, отсюда можно выразить, что G = A + pV.
Растворами называют гомогенные термодинамически устойчивые системы, состоящие из двух или большего числа компонентов, состав которых может меняться в пределах, допустимых растворимостью.
Идеальными называют растворы, образованные компонентами, у которых силы взаимодействия между однородными и разнородными молекулами одинаковы.
