Физико-химические свойства белков
Белки относятся к высокомолекулярным соединениям, их относительная молекулярная масса составляет от 6000 до 1000000 а.е.м. и выше. Для определения молекулярной массы белков используют методы седиментационного анализа, гель-хроматографию и гель-электрофорез. Обычно вычисляют молекулярную массу по скорости седиментации; последнюю выражают через константу седиментации S (сведберг).
Характерные физико-химические свойства белков:
- высокая вязкость растворов;
- незначительная диффузия;
- способность к набуханию;
- оптическая активность;
- подвижность в электрическом поле;
- низкое осмотическое и высокое онкотическое давление;
- способность к поглощению УФ-лучей при 280 нм (имеет важное значение для количественного определения белков);
- белки не проникают через полупроницаемые искусственные мембраны и биомембраны.
Белки – полиэлектролиты, т.к. имеют фунциональные группы, способные к электролитической диссоциации. Визоэлектрической точке (рI) суммарный заряд белков, обладающих амфотерными свойствами, равен нулю, и белки не перемещаются в электрическом поле. В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Для большинства белков животных тканей рI = 5,5-7,0.
Раствор белка называют изоионным, если он не содержит никаких других ионов, кроме ионизированных остатков аминокислот белковой молекулы и ионов, образующихся при диссоциации воды. Изоионная точка белка - значение рН изоионного раствора этого белка. Изоионная и изоэлектрическая точка белка совпадают только в том случае, когда обе равны 7.
КЛАССИФИКАЦИЯ БЕЛКОВ
Согласно функциональному принципу различают 12 главных классов белков:
1) каталитически активные (ферменты);
2) гормоны;
3) регуляторы активности генома;
4) защитные (антитела, белки свертывающей и антисвертывающей систем крови);
5) токсические;
6) транспортные;
7) мембранные;
8) сократительные;
9) рецепторные;
10) ингибиторы ферментов;
11) белки вирусной оболочки;
12) белки с прочими функциями.
Различают a-, β-, a+β- и a/β-белки:
- a-белки содержат a-спирали (не менее 60%);
- β-белки имеют β-структуру (не менее двух антипараллельных цепей);
- a+β–белки включают те и другие структуры в пределах одной полипептидной цепи;
- a/β-белки состоят из a- и β-структур, чередующихся вдоль полипептидной цепи или домена.
В зависимости от химического состава белки делят на 2 группы.
Простые белкисостоят только из остатков аминокислот и при гидролизе распадаются на свободные аминокислоты.
Сложные белки двухкомпонентны: состоят из простого белка и небелковой части (простетической группы).
ПРОСТЫЕ БЕЛКИ
Альбумины и глобулины.
Альбумины - простые белки; входят в состав животных и растительных тканей; содержатся в белке яиц, сыворотке крови, молоке, в семенах растений. Растворимы в воде, солевых растворах, кислотах и щелочах. Примерно 75-80% осмотического давления белков сыворотки крови приходится на альбумины. Они выполняют также функцию транспорта жирных кислот.
Глобулины - группа животных и растительных белков, широко распространённых в природе. Относятся к глобулярным белкам. Растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах. Глобулины, представленные a-фракцией, содержатся в крови в комплексе с билирубином и с липопротеинами высокой плотности. Фракция β-глобулинов включает протромбин, являющийся предшественником тромбина - белка, участвующего в свертывании крови. Фракция g-глобулинов наиболее гетерогенная. Важнейшие g-глобулины - иммуноглобулины.
В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами. Отношение альбумин/глобулин имеет диагностическое значение: в норме оно близко к 2, а при воспалительных заболеваниях - уменьшается.
Протамины и гистоны.
Протамины – низкомолекулярные белки в ядрах сперматозоидов у рыб и птиц. Они содержат 60-85% аргинина и обладают основными свойствами. Хорошо растворяются в воде, кислой и нейтральной среде. Осаждаются щелочами. В ядрах клеток ассоциированы с ДНК.
Гистоны также являются небольшими белками основного характера. В их состав входят лизин и аргинин, содержание которых не превышает
20-30%. Существует пять различных типов гистонов: H1, H2A, H2B, H3 и H4. Эти белки находятся в основном в ядрах клеток, принимают участие в структурной организации хроматина и необходимы для регуляции экспрессии генов.
Проламины и глютелины.
Проламины - белки растительного происхождения. Содержат 20-25% глутаминовой кислоты и 10-15% пролина. Растворимы в 60-80% водном растворе этанола (все остальные простые белки в этих условиях обычно осаждаются).
Глютелины - простые белки, содержатся в семенах злаков, в зеленых частях растений. Для них характерно высокое содержание глутаминовой кислоты и наличие лизина. Растворимы в разбавленных растворах щелочей. Глютелины - запасные белки.
СЛОЖНЫЕ БЕЛКИ
1. Хромопротеины(от греч. chroma - краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины и флавопротеины. Они участвуют в таких процессах, как дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
К группе гемопротеинов относятся гемоглобин, миоглобин, цитохромы, каталаза, пероксидаз. Все они содержат железопорфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции. Видовые различия гемоглобина обусловлены глобином.
Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем- пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 6). В центре гема расположен ион железа в степени окисления +2, связанный с двумя атомами азота ковалентно и с двумя другими - координационными связями. Гем «обернут» одной полипептидной цепью. В гемоглобине железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы пятой координационной связью. Шестая координационная связь железа предназначена для присоединения кислорода или других лигандов (рис. 7).
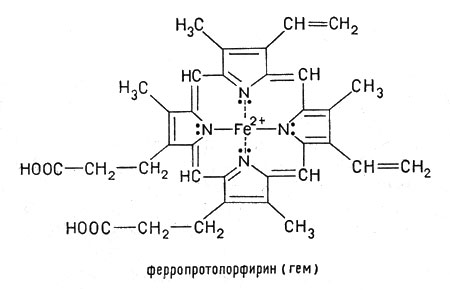 | 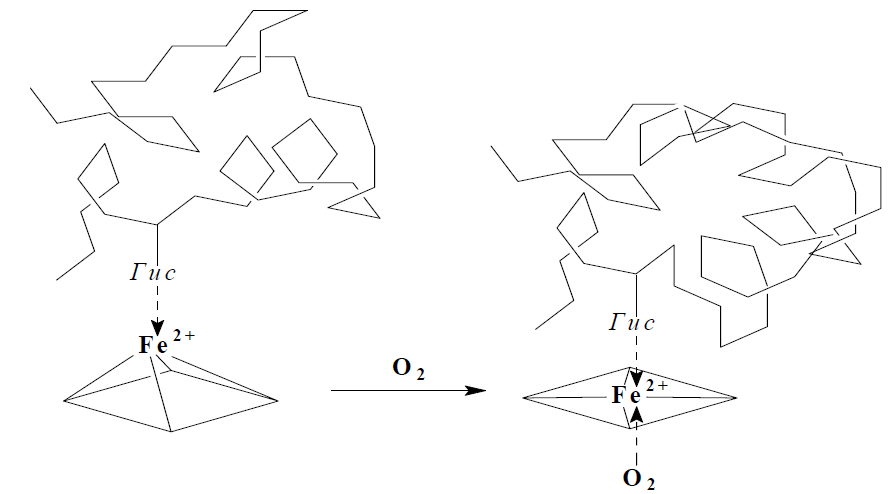 |
| Рис. 6. Гем | Рис. 7. Координационные связи Fe2+ в геме |
Гемоглобин взрослого человека НbА (от англ. аdult - взрослый) имеет четыре полипептидные цепи, составляющие глобин (рис. 8) - белковую часть молекулы. Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи - по 146.
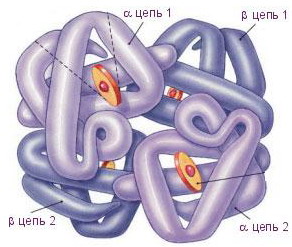 Рис. 8. Гемоглобин Рис. 8. Гемоглобин |
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α-, 2δ-цепи, 2,5%) и НbA3 (менее 1%, отличается строением b-цепи).
Известен фетальный гемоглобин (гемоглобин новорожденных) HbF, состоящий из 2α- и 2γ-цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объему крови плода выполнять функцию снабжения кислородом более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни он почти целиком заменяется на НbА.
Гемоглобинозы – болезни гемоглобинов.
1. Гемоглобинопатии. В их основе лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов мутантных гемоглобинов. Аномальные гемоглобиныразличаются по физико-химическим свойствам (электрофоретическая подвижность, растворимость, изоэлектрическая точка, сродство к кислороду).
Пример гемоглобинопатии - серповидно-клеточная анемия. Заболевание распространено в странах Южной Америки, Африки и Юго-Восточной Азии. Химический дефект сводится к замене глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. HbS после отдачи кислорода в тканях превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде веретенообразных кристаллов (тактоидов). Тактоиды деформируют клетку и приводят к гемолизу. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
Примерами аномальных гемоглобинов являются также гемоглобин С (в b-цепи на 6 месте вместо глутаминовой кислоты находится лизин) и гемоглобин D (в b-цепи на 28 месте вместо глутаминовой кислоты находится лейцин). Данные мутации обнаружены в основном в Африке.
2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α-талассемии, когда не происходит синтез α-цепи, и β-талассемии (не синтезируются β-цепи). Гемоглобинопатия Н (один из вариантов a-талассемии) проявляется гемолитической анемией, выпадением в осадок гемоглобина Н, увеличением селезенки, тяжелыми костными изменениями.
3. Железодефицитные анемии - нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами являются кровопотери и недостаток богатой гемом пищи - мяса и рыбы.
Производные гемоглобина
Оксигемоглобин HbO2.Молекулярный кислород присоединяется к каждому гему Hb при помощи координационных связей железа. Присоединение каждой молекулы кислорода облегчает присоединение последующей. Эта аллостерическая зависимостьполучила название эффекта Бора.Оксигемоглобин, попадая в ткани, теряет кислород, превращаясь в дезоксигемоглобин.
Карбгемоглобин HbCO2 - соединение гемоглобина с углекислым газом. Он нестоек и быстро диссоциирует в легочных капиллярах с отщеплением СО2.
Карбоксигемоглобин HbCO - продукт присоединения оксида углерода CO (угарного газа) к гемоглобину. Гемоглобин имеет высокое сродство к СО и прочно с ним связывается, теряя способность к транспорту кислорода, что приводит к смерти от удушья.
Метгемоглобин MtHb -форма гемоглобина, в которой железо гема находится в трехвалентном состоянии.Не способен переносить кислород. Образуется из свободного гемоглобина под действием различных окислителей, а в организме - при отравлениях нитробензолом, оксидами азота.
Метгемоглобинемия - появление в крови метгемоглобина. Выделяют наследственные и приобретенные метгемоглобинемии. Наследственные развиваются в результате наличия нестабильных или аномальных гемоглобинов. Среди приобретенных могут быть токсические метгемоглобинемии экзогенного происхождения, возникающие при воздействии ряда химических веществ, и эндогенного происхождения, развивающиеся вследствие нарушения продукции и всасывания нитратов при энтероколитах. При значительной метгемоглобинемии развивается кислородное голодание (гипоксия).
Методом качественного определения различных производных гемоглобина является исследование их спектров поглощения.
Миоглобин- глобулярный белок, осуществляющий в мышцах запасание молекулярного кислорода и передачу его окислительным системам клеток. Состоит из одной полипептидной цепи. Как и в гемоглобине, активным центром молекулы, связывающим O2, является гем. Миоглобин определяет цвет мышц.
К хромопротеинам относятся также ферменты каталаза и пероксидаза, входящие в антиоксидантную систему организма, и цитохромы, участвующие в окислительно-восстановительных реакциях и служащие переносчиками электронов.
Флавопротеины –хромопротеины, простетические группы которых представлены производными изоаллоксазина - флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз.
2. Липопротеинысостоят из белка и простетической группы, представленной липидом (нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды). В их образовании участвуют нековалентные связи различной природы, например, гидрофобные или ионные (если в состав входит фосфолипид).
Липопротеины широко распространены и выполняют разнообразные биологические функции (белок ткани легких, липовителлин желтка куриного яйца и т.д.).
Липопротеины присутствуют в свободном состоянии (главным образом в плазме крови). Липопротеины сыворотки крови содержат гидрофобное липидное ядро, окруженное полярными липидами и оболочкой из белков, получивших название апобелки. Они обеспечивают транспорт водонерастворимых липидов.
Липиды, ковалентно связанные с белком, служат якорем, с помощью которого белки прикрепляются к мембране. Это структурированные липопротеины (липиды мембран клетки, миелиновой оболочки нервных волокон).
3. Фосфопротеины- сложные белки, в состав которых в качестве небелкового компонента входит фосфорная кислота, присоединенная к полипептидной цепи сложноэфирной связью через остатки серина или треонина. Возможен также ионный тип связи.
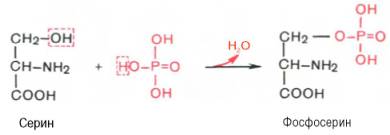
К фосфопротеинам относятся казеиноген молока, овальбумин белка куриного яйца, ряд ферментов (РНК-полимеразы). Фосфопротеины широко представлены в клетках ЦНС.
Фосфопротеины являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и постнатального роста и развития организма, участвуют в регуляции ядерной активности клетки, транспорте ионов и окислительных процессах в митохондриях.
4. Гликопротеины -сложные белки, содержащие, помимо простого белка или пептида, линейные или разветвленные гетероолигосахаридные цепи из 2 - 15 остатков гексоз, пентоз и конечный углевод
(N-ацетилгалактозамин или др.). Углеводный компонент соединяется с белком ковалентными связями:
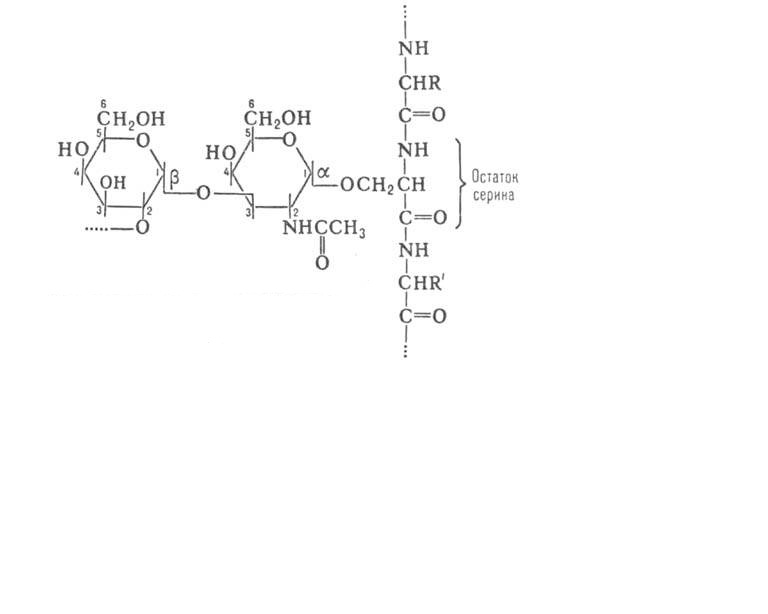
Гликопротеины - белки плазмы крови (кроме альбуминов), некоторые ферменты, муцин слюны, белки хрящевой и костной тканей. Гликопротеины являются важным структурным компонентом клеточных мембран. Они обеспечивают клеточную адгезию, молекулярное и клеточное узнавание. Углеводные компоненты, помимо информативной функции, повышают стабильность молекул, в состав которых они входят, к различного рода химическим, физическим воздействиям, и предохраняют их от действия протеиназ.
Гликопротеины мембран эритроцитов предопределяют группу крови у человека. К типичным гликопротеинам относятся интерфероны, иммуноглобулины.
Интерфероны- ингибиторы размножения многих типов вирусов. Они образуются в клетке в ответ на внедрение вирусной нуклеиновой кислоты. Интерфероны считаются основными защитными белками не только против вирусной инфекции, но и при опухолевых поражениях.
Иммуноглобулины,или антитела, выполняют защитную функцию, обезвреживая поступающие в организм чужеродные вещества – антигены - любой химической природы. Выделяют три основных класса иммуноглобулинов: IgG, IgA, IgM; минорные классы иммуноглобулинов плазмы человека обозначаются как IgD и IgE. Иммуноглобулины разных классов отличаются по молекулярной массе, по концентрации в крови, по биологическим свойствам. Структура иммуноглобулина G приведена на рис. 9. Он состоит из двух идентичных легких L-цепей (от англ. light) и двух идентичных тяжелых
Н-цепей (от англ. heavy). Каждая из этих цепей имеет вариабельные (V) и константные (С) участки.
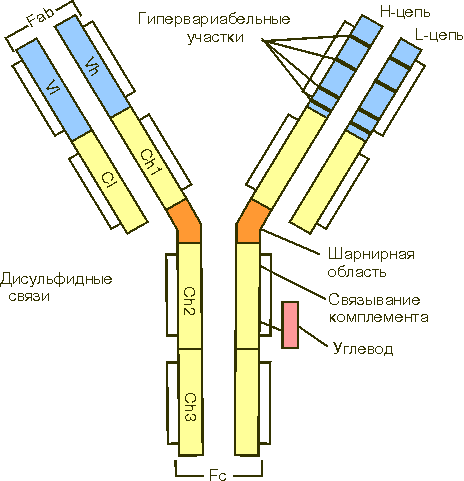
Рис. 9. Структура иммуноглобулина
При ревматоидных артритах часто синтезируются аномальные антитела с необычайно короткими сахарными цепями, что вызывает стимуляцию иммунной системы против самого организма.
Протеогликаны - комплексы белка и гликозаминогликанов. Углевод в этих соединениях составляет основную часть молекулы (до 95%). Типичными гликозаминогликанами являются гиалуроновая кислота (ее основная функция - в соединительной ткани - связывание воды) и гепарин, участвующий в регуляции свертывания крови.
5. Металлопротеины помимо белка содержат ионы какого-либо одного металла или нескольких металлов.
Белки, содержащие негемовое железо:
- ферритин (около 20% железа) сосредоточен главным образом в селезенке, печени, костном мозге. Выполняет роль депо железа в организме;
- трансферрин сыворотки крови (около 0,13% железа) транспортирует ионы железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина.
Металлоферменты - белки, обладающие ферментативной активностью и содержащие катионы металлов.
АТФ-аза содержит Na, K, Са, Мg, алкогольдегидрогеназа – Zn, цитохромоксидаза – Cu, протеиназы - Mg, K.
6. Нуклеопротеины(НП)- устойчивые комплексы нуклеиновых кислот с белками.
Нуклеиновые кислоты (НК) - ДНК и РНК–полимеры нуклеотидов.
ДНК находится в основном в ядре клетки, а также в митохондриях.
РНК обнаруживается во всех частях клетки. Различают мРНК (определяет порядок аминокислот в молекуле белка), рРНК (входит в состав рибосом), тРНК (транспортирует аминокислоты к месту синтеза белка), мяРНК (выполняет каталитические функции). НК обеспечивают хранение и передачу наследственной информации путем программирования синтеза клеточных белков.
В состав нуклеиновых кислот входят азотистые основания (ДНК - аденин, гуанин, цитозин, тимин, РНК - аденин, гуанин, цитозин, урацил), углеводы (дезоксирибоза и рибоза соответственно), остатки фосфорной кислоты.
Нуклеотиды (рис. 10) состоят из трех компонентов: пиримидинового или пуринового основания, пентозы (рибозы) и фосфорной кислоты. Нуклеотиды – нуклеозидфосфаты.
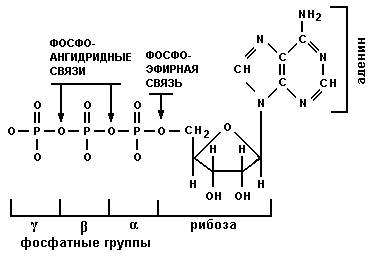 |
| Рис. 10. Строение нуклеотида |
ДНК, выделенная из разных тканей одного и того же вида, имеет одинаковый состав азотистых оснований. Закономерности состава и количественного содержания азотистых оснований установлены впервые Э. Чаргаффом и были названы правилами Чаргаффа:
1. Молярная доля пуриновых оснований равна молярной доле пиримидиновых оснований:
А + Г = Ц + Т.
2. Количество аденина и цитозина равно количеству гуанина и тимина:
А + Ц = Г + Т.
3. Количество аденина равно количеству тимина, количество гуанина равно количеству цитозина:
А = Т, Г = Ц.
4. Коэффициент специфичности равен (Г + Ц)/(А + Т)(у животных
0,54-0,94, у микроорганизмов 0,45-2,57).
