Способы выражения состава раствора
Относительные количества компонентов раствора можно изменять в довольно широких пределах.
Массовая доля– отношение (обычно процентное) массы растворенного вещества к массе раствора.
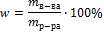
Мольная доля– отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор.
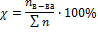
Молярная концентрация (молярность) – отношение количества растворенного вещества к объему раствора.
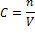
Моляльность (моляльная концентрация) – отношение количества растворенного вещества к массе растворителя. Моляльность раствора в отличие от молярности не изменяется при изменении температуры.
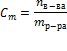
Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора.
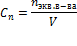
Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом. Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот. Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности.
Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка.
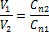
Т.е. объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Образование растворов
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт),другие - в ограниченных (хлорид натрия и вода).
Сущность процесса образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зрения молекулярно-кинетической теории, растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, частицы, находящиеся на поверхности, в результате колебательного движения, увеличивающегося при соударении с частицами растворителя, могут отрываться и переходить в растворитель. Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор.
Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением -кристаллизацией. Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор - наступает равновесие (рис. 4.1).
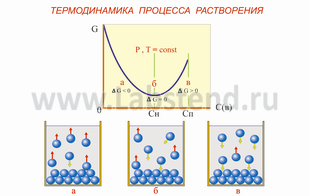
Рис. 4.1 Растворение - кристаллизация твердого вещества
а) ненасыщенный, б) насыщенный, в) пересыщенный растворы
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества - ненасыщенным. Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) - величина постоянная и характеризует растворимость данного вещества в данном растворителе..
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным.Разбавленные растворы- растворы с небольшим содержанием растворенного вещества; концентрированные растворы- растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ - хотя и ненасыщенные, но довольно концентрированными.
Если в систему, состоящую из двух взаимно нерастворимых жидкостей, добавить третий компонент, то он распределится в них в определенном соотношении. Например, если в сосуд, содержащий водный и хлороформный слои, добавить йод, то он будет растворяться в воде и хлороформе до тех пор, пока не установится динамическое равновесие между фазами.
Процесс переноса растворимого вещества из одной жидкой фазы в другую, которая с ней не смешивается или ограниченно смешивается, называются жидкость – жидкостным распределением или распределением между двумя жидкостями.
Количественно этот процесс характеризуется законом распределения Нернста-Шилова, в соответствии с которым отношение концентраций растворенного вещества в обеих фазах при постоянной температуре является постоянным и не зависит от концентрации растворенного вещества:
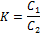
где: К – коэффициент распределения;
Экстракция – это один из случаев жидкость - жидкостного распределения, когда из водного раствора вещество извлекается в органический растворитель.
Реагент, который образует соединение, которое потом экстрагируется, называется экстракционным реагентом, а органический растворитель, использующийся для экстракции или раствор экстракционного реагента в органическом растворителе, называют экстрагентом.

| С1 |
| С2 |
Рис. 4.2 Растворение вещества в двух несмешивающихся жидкостях
4.2 Растворение как физико-химический процесс
